题目内容
【题目】将0.05molSO2(g)和0.03molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g),在一定条件下2min时达到平衡,测得c(SO3)=0.04mol·L-1。以下表述正确的是
2SO3(g),在一定条件下2min时达到平衡,测得c(SO3)=0.04mol·L-1。以下表述正确的是
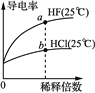
A.若恒容下,充入氮气,则c(SO3)小于0.04mol·L-1
B.该条件下反应的平衡常数为1.6×103
C.v(O2)= 0.02 mol·L-1.min-1
D.使用催化剂若平衡没有移动,则该反应达到化学平衡状态
【答案】B
【解析】
A:恒容下充入氮气,对平衡没有影响,故A错;
B:依据化学平衡三段式列式计算平衡浓度;
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始量(mol/L) 0.05 0.03 0
变化量(mol/L) 0.04 0.02 0.04
平衡量(mol/L) 0.01 0.01 0.04
平衡常数=0.042/(0.012x0.01)=1600=1.6×103,故B正确
C:v(O2)=0.002/2=0.01mol/L D:催化剂只改变反应速率,对平衡移动没影响。

 黎明文化寒假作业系列答案
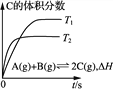
黎明文化寒假作业系列答案【题目】某温度和有催化剂条件下,恒容密闭容器中发生反应N2+3H2 2NH3,下列说法正确的是( )
t/min | 0 | 5 | 10 | 15 | 20 |
c(NH3)/(mol·L-1) | 0 | 1.00 | 1.60 | 1.80 | 1.80 |
A. 0~10min内,v(NH3)=0.16mol·L-1·min-1 B. 0~10min内,v(N2)=0.18mol·L-1·min-1
C. 0~10min内,v(N2)=0.16mol·L-1·min-1 D. 15~20min内,反应v(N2)正= v(N2)逆=0
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。回答下列问题:
(1)ClO2的制备(已知:SO2+2NaClO3+H2SO4═2ClO2+2NaHSO4。)

①整套装置正确的链接顺序为(填A~E)A→_______________。
②装置D的作用是_______________。
(2)ClO2与Na2S的反应
将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入如图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究Ⅰ中反应的产物。

操作步骤 | 实验现象 | 结论 |
取少量Ⅰ中溶液于试管甲中,滴加品红溶液和盐酸 | 品红溶液始终不褪色 | ①无生成 |
另取少量Ⅰ中溶液于试管乙中,加入Ba(OH)2溶液,振荡 | ② | 有 |
③继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙中,_______________ | 有白色沉淀生成 | 有Cl-生成 |
④ClO2与Na2S反应的离子方程式为_______________,用于处理含硫废水时,ClO2相对于Cl2的优点是_______________(任写一条)。
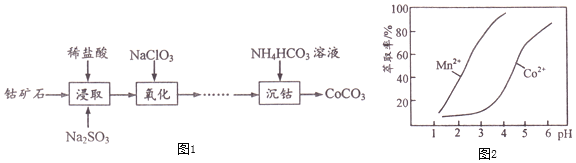
【题目】![]() 主要用作选矿剂、伪装涂料的颜料等。用钴矿石
主要用作选矿剂、伪装涂料的颜料等。用钴矿石![]() 含
含![]() 、CoO及少量
、CoO及少量![]() 、
、![]() 、
、![]() 等
等![]() 生产
生产![]() 的流程如图1:
的流程如图1:
下表列出了几种离子生成氢氧化物沉淀的pH![]() “沉淀完全”是指溶液中离子浓度低于
“沉淀完全”是指溶液中离子浓度低于![]()
|
|
|
|
| |
开始沉淀的pH |
|
|
|
|
|
沉淀完全的pH |
|
|
|
|
|
![]() 写出“浸取”步骤
写出“浸取”步骤![]() 发生反应的离子方程式______。
发生反应的离子方程式______。
![]() “浸取”步骤除
“浸取”步骤除![]() 外,钴矿石中还能被
外,钴矿石中还能被![]() 还原的物质有______。
还原的物质有______。
![]() 加
加![]() 的目的是氧化
的目的是氧化![]() ,
,![]() 的用量过多会造成的不良后果是______。
的用量过多会造成的不良后果是______。
![]() “沉钴”步骤向
“沉钴”步骤向![]() 溶液加入
溶液加入![]() 溶液需要
溶液需要![]() 条件下进行,适宜的加热方式为______。温度控制在
条件下进行,适宜的加热方式为______。温度控制在![]() 的原因为______。
的原因为______。
![]() 已知金属萃取剂对金属离子的萃取率与pH的关系如图2所示。请补充完整由“氧化”后的溶液制备
已知金属萃取剂对金属离子的萃取率与pH的关系如图2所示。请补充完整由“氧化”后的溶液制备![]() 的实验方案:向“氧化”后的溶液中加入______,加入
的实验方案:向“氧化”后的溶液中加入______,加入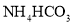 溶液沉钴得
溶液沉钴得![]() 实验中须使用试剂:
实验中须使用试剂:![]() 溶液、金属萃取剂、盐酸
溶液、金属萃取剂、盐酸![]() 。
。