题目内容
【题目】恒温25 ℃下,向一定量的0.1 mol·L-1的BOH溶液中逐滴滴入稀盐酸。溶液中水电离出的氢离子浓度的负对数[用pC表示,pC=-lgc(H+)水]与加入盐酸体积的关系如图所示。下列叙述错误的是( )
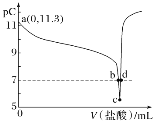
A.BOH为弱碱且Kb的数量级为10-5
B.b点溶液中:c(B+)=c(Cl-)
C.c点溶液中水的电离程度最大
D.c~d点间溶液中:c(BOH)+c(OH-)>c(H+)
【答案】D
【解析】
A.根据图象可知,加入HCl溶液体积为0时,溶液为BOH碱性溶液,水电离出的c水(H+)=10-11.3mol·L-1,则0.1mol·L-1的BOH溶液电离出的c(OH-)=![]() mol·L-1=10-2.7mol·L-1,说明BOH为弱碱,Kb=
mol·L-1=10-2.7mol·L-1,说明BOH为弱碱,Kb=![]() =10-4.4,Kb的数量级为10-5,故A正确;
=10-4.4,Kb的数量级为10-5,故A正确;
B.pH=7,溶液呈中性,b点溶液中:由电荷守恒c(H+)+c(B+)=c(Cl-)+c(OH-)可得:c(B+)=c(Cl-),故B正确;
C.c点恰好反应生成BCl,强酸弱碱盐,其水解促进水电离,水电离程度最大,故C正确;
D.c点溶质为BCl,结合质子守恒可得:c(BOH)+c(OH-)=c(H+),cd段HCl过量,则c(BOH)+c(OH-)<c(H+),故D错误;
故选D。

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目