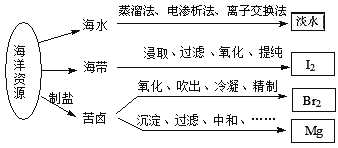
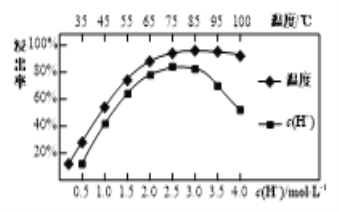
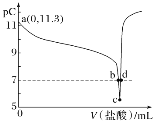
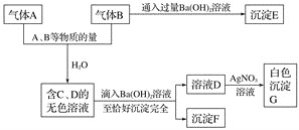
题目内容
【题目】工业制硫酸中的一步重要反应是二氧化硫在400~600℃下的催化氧化:2SO2+O2![]() 2SO3。如果反应在密闭容器中进行,下列有关的叙述不正确的是( )
2SO3。如果反应在密闭容器中进行,下列有关的叙述不正确的是( )
A.使用催化剂是为了加快反应速率,提高生产效率
B.在上述条件下,SO2、O2、SO3将共存于反应体系之中
C.当生成O2的速率与生成SO3的速率相等时达到了平衡
D.为了提高SO2的转化率,可适当地提高O2的浓度
【答案】C
【解析】
A.使用催化剂能加快反应速率,缩短反应时间,提高生产效率,与题意不符,A错误;
B.该反应为可逆反应,存在反应限度,反应物不可能100%的转化,反应达到平衡时SO2、O2、SO3三种物质都存在,与题意不符,B错误;
C.生成氧气的速率(逆反应速率)与生成三氧化硫的速率(正反应速率)相等(1∶1),不等于其化学计量数之比(1∶2),此时未达到平衡状态,符合题意,C正确;
D.增大反应物氧气的浓度,可以提高另一种反应物二氧化硫的转化率,与题意不符,D错误;
答案为C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目