题目内容
【题目】实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.3 mol·L-1硫酸溶液480 mL。根据这两种溶液的配制情况回答下列问题:
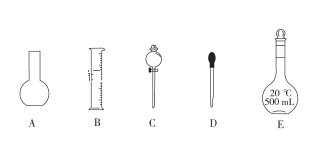
(1)如图是已提供仪器,配制上述溶液均需用到的玻璃仪器是________(填选项)。
(2) 下列操作会使配制的NaOH溶液浓度偏低的是__________。
A 称量NaOH所用砝码生锈
B 选用的容量瓶内有少量蒸馏水
C 定容摇匀后,液面下降,又加水至刻度线
D 定容时俯视刻度线
(3)根据计算用托盘天平称取NaOH的质量为________g。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为__________mL(计算保留一位小数)。
【答案】BDE C 2.0 8.2
【解析】
(1)根据配制一定物质的量浓度溶液用到仪器选择;
(2)分析不当操作对溶质的物质的量和溶液体积的影响,依据C=![]() 进行误差分析,凡是能够使n增大,或者使V减小的操作,都会使C偏大;凡是能够使n减小,V增大的操作都会使C偏小;凡是不当操作导致实验失败且无法补救的,需要重新配制;
进行误差分析,凡是能够使n增大,或者使V减小的操作,都会使C偏大;凡是能够使n减小,V增大的操作都会使C偏小;凡是不当操作导致实验失败且无法补救的,需要重新配制;
(3)依据n=cv计算需要的氢氧化钠的物质的量,m=nM计算氢氧化钠的质量;
(4)根据c=![]() 计算浓硫酸的浓度,再根据浓硫酸稀释前后溶质的物质的量不变计算,计算浓硫酸的体积。
计算浓硫酸的浓度,再根据浓硫酸稀释前后溶质的物质的量不变计算,计算浓硫酸的体积。
(1)配制一定物质的量浓度溶液用到仪器:托盘天平、量筒、500mL容量瓶、烧杯、玻璃棒、胶头滴管、药匙等;
故答案为:BDE;
(2) A称量NaOH所用砝码生锈,称取的氢氧化钠的质量增多,n偏大,则浓度偏高,故A不选;
B. 选用的容量瓶内有少量蒸馏水,对溶液的体积不会产生影响,所配溶液准确,故B不选;
C. 定容摇匀后,液面下降,又加水至刻度线,相当于多加了水,溶液的体积偏大,浓度偏小,故C选;
D. 定容时俯视刻度线,使溶液的体积偏小,浓度偏大,故D不选;
故选:C。
(3) 0.1mol/LNaOH溶液450mL,需选择500ml的容量瓶,0.1mol/LNaOH溶液500mL中含有的氢氧化钠的物质的量为:0.1mol/L×0.5L=0.05mol,需要氢氧化钠的质量为:40g/mol×0.05mol=2.0g,
故答案为:2.0;
(4) 质量分数为98%、密度为1.84g/cm3的浓硫酸的浓度为:c=![]() 1000×1.84×98%÷98=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.3mol/L×0.5L,得V=0.0082L=8.2ml,
1000×1.84×98%÷98=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.3mol/L×0.5L,得V=0.0082L=8.2ml,
故答案为:8.2。