题目内容
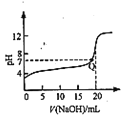
【题目】室温下,向20 mL l mol/L的某二元弱酸H2X溶液中逐渐加入NaOH固体(忽略溶液温度及体积变化),测得溶液中的H2X、HX-、X2-的物质的量浓度与溶液pH变化关系如图。下列叙述错误的是( )
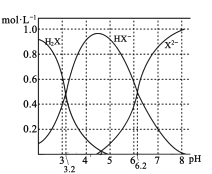
A.NaHX的水溶液呈酸性
B.当加入NaOH固体0.01 mol时,溶液pH= 3.2
C.当加入NaOH固体0.02 mol时,溶液中的离子浓度大小关系为:c(Na+)>c(HX-)>c(H+)>c(X2-)> c(OH-)
D.当加入NaOH固体0.04 mol时,溶液中水的电离程度最大
【答案】B
【解析】
A. 由H2X和HX-曲线的相交点可知,酸的Ka1=1.0×10-3.2,由X-与HX-曲线的相交点可知酸的Ka2=1.0×10-6.2,可以计算NaHX的水解平衡常数Kh=Kw/ Ka1=1.0×10-10.8<Ka1,所以NaHX的水解小于其HX-的电离,从而NaHX的水溶液呈酸性,A正确;
B. 当加NaOH固体0.01mol时,溶液中的溶质为H2X和NaHX,两者的浓度相同,但因H2X的电离大于NaHX的水解,所以溶液中H2X与HX-的浓度并不相同,且H2X的电离大于HX-的水解,所以溶液pH>3.2,B错误;
C. 当加入NaOH固体0.02mo时,溶液溶质即为NaHX,因HX-的电离大于HX-的水解,所以c(Na+)>c(HX-)>c(H+)>c(X2-)>c(OH-),C正确
D. 当加入NaOH固体0.04mol时,液的溶质为Na2X,水解能力最强,水的电离程度最大D正确;故答案为:B。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
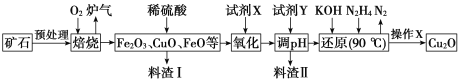
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是___________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为___________。
(2)试剂X是H2O2溶液,当试剂X是___________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是________。
(4)“还原”步骤中为提高N2H4转化率可采取的措施有_________(填序号)。
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为_______________
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是____________。
(7)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式为________
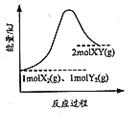
(8)工业上用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g)HCN(g)+3H2(g ) △H>0。其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。则X可以是___________(填字母序号)
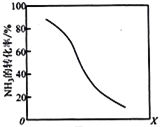
a.温度 b.压强 c.催化剂 d.