题目内容
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
请回答下列问题:
(1)用电子式描述a~g中电负性最大和最小的元素形成化合物的过程:
。
(2)c的单质的结构式为: ,已知互为等电子体的分子具有相似的价键结构,写出由上述元素组成与c的单质互为等电子体的电子式(任一种): 。
(3)g元素在周期表中的位置是第四周期, 族,该元素在周期表分区中属于 区;写出g的基态原子的外围电子排布式: 。
(4)分别由a、b、d、f元素形成的单质晶体的熔沸点由高到低顺序为(用单质的化学式表示): 。
(5)写出由a、b、c、d元素组成,原子个数比为5∶1∶1∶3的化合物与足量烧碱溶液反应的离子方程式: 。
| a | | | |||||||||||||||
| | | | | b | c | d | | | |||||||||
| e | | | f | | | | | ||||||||||
| | | | | | | | g | | | | | | | | | | |
(1)用电子式描述a~g中电负性最大和最小的元素形成化合物的过程:
。
(2)c的单质的结构式为: ,已知互为等电子体的分子具有相似的价键结构,写出由上述元素组成与c的单质互为等电子体的电子式(任一种): 。
(3)g元素在周期表中的位置是第四周期, 族,该元素在周期表分区中属于 区;写出g的基态原子的外围电子排布式: 。
(4)分别由a、b、d、f元素形成的单质晶体的熔沸点由高到低顺序为(用单质的化学式表示): 。
(5)写出由a、b、c、d元素组成,原子个数比为5∶1∶1∶3的化合物与足量烧碱溶液反应的离子方程式: 。
(1) (2)N≡N
(2)N≡N 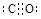 或
或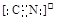
(3)Ⅷ d 3d64s2 (4)C>Si>O2>H2
(5)NH+4+HCO-3+2OH-=NH3·H2O+CO2-3+H2O
 (2)N≡N
(2)N≡N 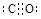 或
或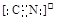
(3)Ⅷ d 3d64s2 (4)C>Si>O2>H2
(5)NH+4+HCO-3+2OH-=NH3·H2O+CO2-3+H2O
试题分析:(1)非金属性越强,电负性越大,所以根据元素的位置可知,非金属性最强的是O,最小的是Na,二者形成的化合物是氧化钠,含有离子键,其形成过程可表示为
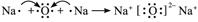 。
。(2)C是氮元素,其单质是氮气,含有三键,结构式是N≡N;价电子数和原子数分别都相等的是等电子体,所以和氮气互为等电子体的是CO或CN-,其电子式分别是
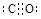 或
或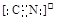 。
。(3)g是铁元素,位于第四周期第Ⅷ族;区的名称来自于按照构造原理最后填入电子的轨道名称,所以铁属于d区,其基态原子的外围电子排布式3d64s2。
(4)a、b、d、f元素形成的单质分别是氢气、碳、氧气和硅,其晶体类型分别是分子晶体、原子晶体、分子晶体和原子晶体,所以熔沸点由高到低顺序为C>Si>O2>H2。
(5)由a、b、c、d元素组成,原子个数比为5∶1∶1∶3的化合物是碳酸氢铵,和足量氢氧化钠溶液反应的离子方程式是NH+4+HCO-3+2OH-=NH3·H2O+CO2-3+H2O。
点评:该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。本题基础性较强,重点突出。

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目

 ,下列叙述判断正确的是( )
,下列叙述判断正确的是( )

 C→E的化学方程式为
C→E的化学方程式为