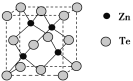
题目内容
【题目】下列有关能量的叙述不正确的是( )
A.活化能的大小对化学反应的能量变化不产生影响
B.化学键的断裂和形成是化学反应中发生能量变化的主要原因
C.HCl(aq)和NaOH(aq)反应的中和热为57.3kJ/mol,则CH3COOH(aq)和NaOH(aq)完全反应生成1molH2O(l)时,放出的热量为57.3kJ
D.CO(g)的燃烧热是283.0kJ/mol,则反应2CO2(g)=2CO(g)+O2(g)的反应热![]() =+566.0kJ/mol
=+566.0kJ/mol
【答案】C
【解析】
A.活化能的大小对反应的难易程度有影响,对化学反应前后的能量变化不产生影响,故A正确;
B.化学变化的实质为旧键断裂和新键形成,则化学键的断裂和形成是化学反应中能量变化的主要原因,故B正确;
C.![]() 是弱酸电离吸热,放出的热量小于
是弱酸电离吸热,放出的热量小于![]() ,故C错误;
,故C错误;
D.![]() 的燃烧热是
的燃烧热是![]() ,则表示燃烧热的热化学方程式为:
,则表示燃烧热的热化学方程式为:![]() ,互为可逆反应的
,互为可逆反应的![]() 符号相反,计量数变化几倍,
符号相反,计量数变化几倍,![]() 也要变化几倍,所以
也要变化几倍,所以![]() 反应的
反应的![]() ,故D正确;
,故D正确;
故答案为C。

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目