题目内容
【题目】工业上以软锰矿(主要成分是MnO2,还含有少量SiO2、Fe2O3)为主要原料制备高性能的磁性材料碳酸猛(MnCO3)。其工业流程如图所示,下列说法错误的是
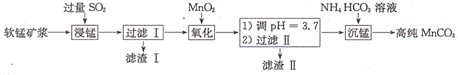
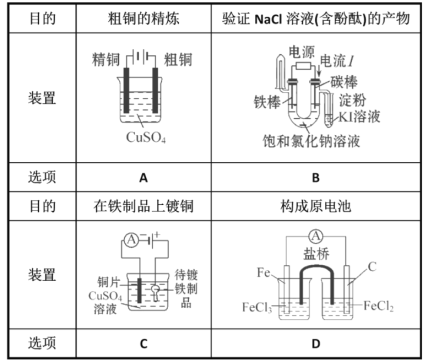
A.滤渣I可用于制造光导纤维、滤渣II可用于制作颜料
B.“浸锰”过程MnO2参与反应的化学方程式为MnO2十SO2=MnSO4
C.“沉锰”时,反应体系的温度越高,越有利于生成MnCO3
D.检验高纯碳酸锰是否洗涤干净,可选用BaCl2溶液和盐酸试剂
【答案】C
【解析】
A.分析流程可知,滤渣I为二氧化硅,可用于制造光导纤维、滤渣II为氢氧化铁,氢氧化铁受热分解生成三氧化二铁,三氧化二铁可用于制作颜料,A正确;
B.软锰矿浆中通入足量的二氧化硫,二氧化锰与二氧化硫发生氧化还原反应生成硫酸锰,反应方程式为MnO2十SO2=MnSO4,B正确;
C.“沉锰”时,反应体系的温度越高,碳酸氢铵越容易分解,碳酸氢铵的原料利用率越低,C错误;
D.生成的碳酸锰沉淀需经充分洗涤,若未洗涤干净,洗涤液中含有硫酸根离子,故检验洗涤液中是否含有硫酸根离子即可,方法为:取1~2mL最后一次洗涤液与试管中,滴加盐酸酸化,无明显现象,在滴加氯化钡溶液,若无白色沉淀产生,则洗涤干净,D正确;
答案选C。

练习册系列答案
 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目