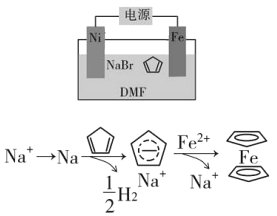
题目内容
【题目】某兴趣小组设计步骤用滴定法测定AgBrO3的溶度积常数.回答下列问题:
步骤I:试剂的配制
分别配制1L0.025molL-1KBrO3溶液、1L0.025rrolL-1AgNO3溶液、lL0.05molL-1Na2S2O3溶液。
(1)配制Na2S2O3溶液所使用的蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除______________(写名称)及二氧化碳。
步骤II:AgBrO3饱和溶液配制
用棕色滴定管量取20.00mL0.025molL-1AgNO3溶液于干燥的锥形瓶中,然后用另一支滴定管量取20.00mL0.025molL-1KBrO3溶液注入到锥形瓶中,摇动锥形瓶使沉淀完全,把沉淀陈化3~5min,用过滤器过滤,滤液用于燥洁净的小烧杯盛接。
(2)量取AgNO3溶液所使用的滴定管为棕色的目的是______________。
(3)如果滤液浑浊需要进行的操作为______________。
步骤III:AgBrO3饱和溶液中BrO3-浓度的测定
准确量取20.00mL所得滤液注入碘量瓶中,再加入20mL10%的KI溶液、l5mLlmolL-1的硫酸并加50.00rnL水混匀,放置3~5min,以淀粉为指示剂,用Na2S2O3溶液滴定,消耗Na2S2O3溶液17.86mL(发生的反应BrO3-+6H++6I-=Br-+3I2+3H2O;2Na2S2O3+I2=Na2S4O6+2NaI)。
(4)滴定到终点时的现象为______________。
(5)滤液中BrO3-的浓度为______________(保留3位有效数字,下同),AgBrO3的溶度积测定值为______________。
(6)步骤II中滤液若没有澄清,会使测量值______________(填“偏高”“偏低”或“无影响”,下同);盛接滤液的小烧杯中有少量水存在,会使测量值________。
【答案】氧气 防止AgNO3溶液见光分解 重新过滤 滴入最后一滴标准溶液,蓝色刚好褪去,且半分钟内不恢复原色(或其他合理表述) 7.44×l0一3molL-1 5.54×l0一5 偏高 偏低
【解析】
(1)配制具有还原性的物质,为了防止其被氧化,因此需要将蒸馏水煮沸,冷却室温,在溶解;
(2)对于见光易分解的物质,通常保存在棕色试剂瓶中,滴定操作时,对于见光易分解的物质,应使用棕色滴定管;
(3)根据滤液依旧浑浊,说明没有过滤干净,滤液中有滤渣;
(4)根据I2能使淀粉溶液变蓝,判断滴定终点;
(5)根据发生的反应有BrO3-+6H++6I-=Br-+3I2+3H2O、2Na2S2O3+I2=Na2S4O6+2NaI,因此由方程式确定关系式为![]() ,根据关系式法,确定的BrO3-浓度,然后计算AgBrO3的溶度积;
,根据关系式法,确定的BrO3-浓度,然后计算AgBrO3的溶度积;
(6)误差分析,分析消耗Na2S2O3溶液体积是偏大还是偏小。
(1)配制Na2S2O3溶液,应避免Na2S2O3被氧化,故配制Na2S2O3溶液所使用的蒸馏水必须经过煮沸,可以除去蒸馏水中溶解的氧气、二氧化碳等;
(2)AgNO3见光易分解,故量取AgNO3溶液所使用的滴定管为棕色的目的是防止AgNO3溶液见光分解;
(3)滤液浑浊说明没有过滤干净,需要重新过滤;
(4)碘遇淀粉变蓝,当I2全被Na2S2O3还原为I-时,溶液蓝色消失,故滴定到终点时的现象为当滴入最后一滴标准溶液,蓝色刚好褪去,且半分钟内不恢复原色;
(5)发生的反应有BrO3-+6H++6I-=Br-+3I2+3H2O、2Na2S2O3+I2=Na2S4O6+2NaI,因此由方程式确定关系式为BrO3- ~ 3I2 ~ 6Na2S2O3,Na2S2O3的物质的量为0.05molL-1×0.01786L=0.00893mol,c(BrO3-)= =0.00744molL-1,AgBrO3的溶度积为0.00744×0.00744=5.54×10-5;
=0.00744molL-1,AgBrO3的溶度积为0.00744×0.00744=5.54×10-5;
(6)步骤II中滤液若没有澄清,则AgBrO3过量,参与反应,消耗Na2S2O3溶液的体积偏大,则滴定结果偏高,盛接滤液的小烧杯中有少量的水存在,则c(BrO3-)偏小,会使测定值偏低。