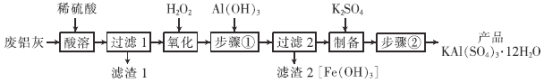
题目内容
【题目】钛酸钡(BaTiO3)主要用于电子陶瓷、PTC热敏电阻、电容器等多种电子元器件的配制中。某工厂以重晶石(主要含BaSO4)为原料生产钛酸钡的工艺流程如图:

回答下列问题:
(1)利用焰色反应的原理可定性鉴别某些金属盐。灼烧钛酸钡样品时,钡的焰色为______(填标号)。
A.砖红色 B.黄绿色 C.紫色 D.黄色
(2)用Na2CO3溶液浸泡重晶石(杂质不与Na2CO3反应),能将BaSO4转化为BaCO3,此反应的平衡常数K=_________。(已知Kap(BaSO4)=1.2×10-10、Kap(BaCO3)=2.4×10-9)。
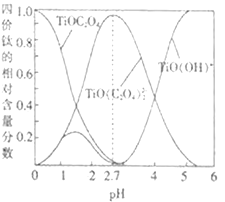
(3)流程中“混合”溶液中的钛元素在不同pH时主要以Ti(OH)+、TiOC2O4、TiO(C2O4)23-这三种形式存在(变化曲线如图所示)。实际制备工艺中,先用氨水调节混合溶液的pH在______,再进行“沉淀”,写出该条件下生成草酸氧钛钡晶体的离子方程式:__________。
(4)检验草酸氧钛钡晶体是否洗涤干净的操作是_________。
(5)隔绝空气煅烧草酸氧钛钡晶体得到BaTiO3的同时,还能得到气体产物有H2O(g)、________;
(6)BaTiO3成品中C2O42-的含量可以用“氧化还原滴定法”测得。称取m g样品,置于烧杯中,加入50mL0.2 mol·L-1酸性高锰酸钾溶液充分反应后配制成100mL溶液,取20mL该溶液于锥形瓶中用0.1 mol·L-1的硫酸亚铁溶液进行滴定,滴定达到终点的标志是__________,重复滴定3次,平均每次消耗硫酸亚铁溶液的体积为20mL,则BaTiO3成品中C2O42-的质量分数为_________。
【答案】B 0.05 2.7 TiO(C2O4)22-+Ba2++nH2O=BaTiO(C2O4)2nH2O↓ 取最后一次洗涤流出液于试管,加入少量硝酸酸化的AgNO3溶液,若试管中无白色浑浊出现,则证明已洗涤干净 CO、CO2 滴入最后一滴硫酸亚铁溶液,溶液由紫红色变为浅绿色,且半分钟不变色 ![]() %
%
【解析】
由制备流程可知,用饱和Na2CO3溶液处理重晶石,将BaSO4转化为易溶于酸的BaCO3,碳酸钡与盐酸反应生成氯化钡,然后氯化钡与四氯化钛、草酸和氨水反应生成BaTiO(C2O4)2nH2O沉淀,过滤、洗涤、干燥、煅烧得到BaTiO3,据此分析解答。
(1)Ba元素的焰色为绿色,Na元素焰色为黄色、K元素焰色为紫色、Ca元素焰色为砖红色,故选B;
(2)将BaSO4转化为易溶于酸的BaCO3的离子方程式为:BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq),该反应的平衡常数K=
BaCO3(s)+SO42-(aq),该反应的平衡常数K=![]() =
=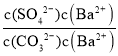 =
=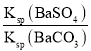 =
=![]() =0.05,故答案为:0.05;
=0.05,故答案为:0.05;
(3)根据“沉淀”时生成草酸氧钛钡晶体中含有TiO(C2O4)22-,因此实际制备工艺中,先用氨水调节混合溶液的pH在2.7,使得钛元素主要以TiO(C2O4)22-存在;根据沉淀的化学式可知,反应的离子方程式:TiO(C2O4)22-+Ba2++nH2O=BaTiO(C2O4)2nH2O↓,故答案为:2.7;TiO(C2O4)22-+Ba2++nH2O=BaTiO(C2O4)2nH2O↓;
(4)BaTiO(C2O4)2nH2O沉淀表面附着氯离子,检验洗涤液中是否存在氯离子即可,故方法为:取最后一次洗涤流出液于试管,加入少量硝酸酸化的AgNO3溶液,若试管中无白色浑浊出现,则证明已洗涤干净,故答案为:取最后一次洗涤流出液于试管,加入少量硝酸酸化的AgNO3溶液,若试管中无白色浑浊出现,则证明已洗涤干净;
(5)煅烧草酸氧钛钡晶体得到BaTiO3的同时,失去结晶水生成水蒸气,草酸根离子生成二氧化碳、CO,所以生成高温下的气体产物有CO、CO2和H2O(g),故答案为:CO、CO2;
(6)高锰酸根离子是紫红色,当滴入最后一滴硫酸亚铁溶液,溶液由紫红色变为浅绿色,且半分钟不变色,证明达到滴定终点;称取m g样品,置于烧杯中,加入50mL0.2 mol·L-1酸性高锰酸钾溶液充分反应后配制成100mL溶液,取20mL该溶液于锥形瓶中用0.1 mol·L-1的硫酸亚铁溶液进行滴定,根据2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,5Fe2++MnO4-+8H+=5Fe3+ +Mn2++4H2O,与亚铁离子反应的高锰酸根离子的物质的量为![]() ×0.1 mol·L-
×0.1 mol·L-![]() =0.002mol,则与C2O42-反应的高锰酸根离子为0.05L×0.2 mol·L-1-0.002mol=0.008mol,则C2O42-为
=0.002mol,则与C2O42-反应的高锰酸根离子为0.05L×0.2 mol·L-1-0.002mol=0.008mol,则C2O42-为![]() ×0.008mol=0.02mol,则m g样品中C2O42-的质量分数为
×0.008mol=0.02mol,则m g样品中C2O42-的质量分数为![]() ×100%=
×100%=![]() %,故答案为:滴入最后一滴硫酸亚铁溶液,溶液由紫红色变为浅绿色,且半分钟不变色;
%,故答案为:滴入最后一滴硫酸亚铁溶液,溶液由紫红色变为浅绿色,且半分钟不变色;![]() %。
%。

 名校课堂系列答案
名校课堂系列答案