��Ŀ����
����Ŀ���������ճ���������;�dz��㷺���÷����ң���Al��Al2O3��Fe��Fe2O3��FeO �ȣ�Ϊԭ����ȡ�����Ĺ�����������ͼ���ش��������⣺
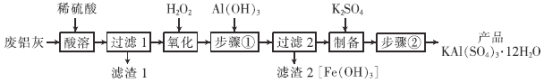
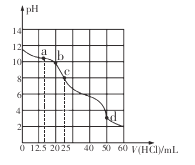
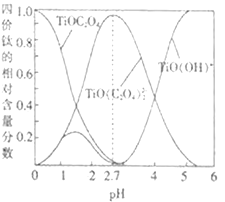
��֪��Fe3����ʼ������������ȫʱ��Һ��pH Ϊ1.9��3.7��
��1��������ˮ��ԭ����_______________________�������ӷ���ʽ��ʾ����
��2����������ʱ��Al2O3�ܽ�Ļ�ѧ����ʽΪ______________________��
��3����������ʱ��������Ӧ�����ӷ���ʽΪ_______________��
��4�������������Ŀ����______��������2������ϴ��ˮϴ����������գ��õ��IJ�Ʒ��������_____�����׳ƣ���
��5����������������IJ�����_________��__________�����˼����
���𰸡�Al3++3H2OAl(OH)3(����)+3H+ Al2O3+3H2SO4=Al2(SO4)3+3H2O 2Fe2++H2O2+2H+=2Fe3++2H2O ������ҺpH��ʹ������ȫ ���� ����Ũ�� ��ȴ�ᾧ
��������
������(��Al��Al2O3��Fe��Fe2O3��FeO ��)��������ϡ�����������ܽⲢ���ˣ��õ�����Al3+��Fe2+��Fe3+��SO42-��������Һ������1Ϊ�������ᷴӦ�����ʣ�����Һ�м���˫��ˮ����Һ�е�Fe2+����ΪFe3+������Fe(OH)3��Al(OH)3�����ܣ������������Һ�м���Al(OH)3��Fe3+ת��Ϊ�����ܵ�Fe(OH)3���������˺�õ�����Al3+��SO42-����Һ������2ΪFe(OH)3������Һ�м���K2SO4�Ƶò�Ʒ��Һ������Һ��������Ũ������ȴ�ᾧ�����ˡ��������յõ���Ʒ�������صľ��壬�ݴ˷������
(1)������ǿ�������Σ����������Al3+ˮ����������������壬�ܹ�����ˮ�������������γɳ�������ȥ���Ӷ��ﵽ�ﵽ��ˮ��Ŀ�ġ��䷴Ӧԭ���÷���ʽ��ʾΪ��Al3++3H2OAl(OH)3(����)+3H+��
(2)��������ʱ��Al2O3�����ᷴӦ������������ˮ����ѧ����ʽΪAl2O3+3H2SO4=Al2(SO4)3+3H2O��
(3)��������ʱ�������������������⣬����Һ�е�Fe2+����ΪFe3+��������Ӧ�����ӷ���ʽΪ2Fe2++H2O2+2H+=2Fe3++2H2O��
(4)���������������Һ�м���Al(OH)3�������ǵ�����Һ��pHֵ������Fe(OH)3��Al(OH)3�����ܣ�ʹFe3+��ȫת��ΪFe(OH)3��������ȥ��������2���ijɷ���Fe(OH)3������ʱ�ֽ�����������������һ�ֺ���ɫ��ĩ�����������ϣ����������죻
(5) ����������Ǵ���Һ�л�ò�Ʒ�����������IJ���������Ũ������ȴ�ᾧ�����˼����

����Ŀ����ѧ��Ӧԭ�����о���ѧϰ��ѧ����Ҫ���ݡ��ش��������⣺
��1����֪������ȼ���ȡ�H����285.5kJmol��1������ˮ���Ȼ�ѧ����ʽΪ_____
��2����298K��101kPa�£�2SO2��g��+O2��g��2SO3��g����H����198kJmol��1������ͬ�����£�2mol SO2�� 1 mol O2��ַ�Ӧ�����շų�������_____198kJ������ڡ���С�ڻ��ڡ������÷�Ӧ��ƽ�ⳣ������ʽK��_____��
��3��25��ʱ���±�ΪһЩ���ܵ���ʵ�������ݣ�
���� | Fe��OH��2 | Cu��OH��2 | Fe��OH��3 |
��ʼ����ʱ��pH | 5.8 | 4.1 | 2.0 |
��ȫ����ʱ��pH | 8.3 | 6.4 | 3.2 |
�����£���ȥ����CuCl2��Һ�к��е�����FeCl2�����������Ϊ��
��Ӧ�ȼ���_____�����Լ����ƣ������������ӷ�Ӧ����ʽΪ_____
���ټ���CuO��������Һ��pH��_____��Χ�ڣ�ʹ��Һ�е�Fe3+ת��ΪFe��OH��3���������ˡ�