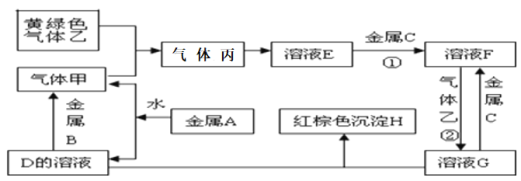
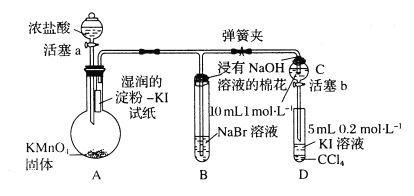
题目内容
【题目】某蓄电池的反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)该蓄电池充电时,发生还原反应的物质是________(填选项字母)。放电时生成Fe(OH)2的质量为18 g,则外电路中转移的电子数是________________。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,或与该蓄电池的________(填“正”或“负”)极相连。
(3)以该蓄电池作电源,用如图所示的装置进行电解,一段时间后发现溶液逐渐变浑浊,Al电极附近有气泡生成,写出此过程中阳极的电极反应式______________________ 。
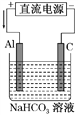
【答案】 C 0.4NA或2.408×1023 负 Al+3HCO3--3e-===Al(OH)3↓+3CO2↑
【解析】试题分析:充电时Fe(OH)2、Ni(OH)2生成NiO2、Fe、H2O,铁元素化合价降低、镍元素化合价升高;放电时Fe失电子生成Fe(OH)2;(2)金属的电化学保护方法有牺牲阳极的阴极保护法和外接电流阴极保护法;(3)Al电极与电源正极相连,Al做阳极失电子发生氧化反应。
解析:充电时Fe(OH)2、Ni(OH)2生成NiO2、Fe、H2O,铁元素化合价降低、镍元素化合价升高,所以发生还原反应的物质是Fe(OH)2,故选C;18 gFe(OH)2的物质的量是0.2mol,放电时Fe失电子生成Fe(OH)2,当生成Fe(OH)2的质量为18 g时,外电路中转移的电子数是0.4NA;(2)金属与蓄电池的负极相连,做电解池阴极,阴极发生还原反应,金属被保护,属于外接电流阴极保护法;(3)Al电极与电源正极相连,Al做阳极失电子发生氧化反应,阳极的电极反应式是Al+3HCO3--3e-===Al(OH)3↓+3CO2↑。