题目内容
光气(COCl2)在塑料等工业中有许多用途,COCl2的分解反应为:COCl2(g)  Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如大图(每次仅改变一个条件):
Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如大图(每次仅改变一个条件):
①比较第2 min 反应温度T(2)与第8 min反应温度T(8)的高低:T(2) T(8)
②比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率
[分别以v(2~3)、v(5~6)、v(12~13)表示]的大小
③比较第14min时,使平衡移动采取措施可以是
④比较第8 min和第16min时,平衡常数K值(分别用K8,K16表示)大小关系是
⑤COCl2在达平衡时的转化率中最大的是第 min(范围)
⑥计算出第4min之后再达平衡的混合气体中,平均相对分子质量最大数值是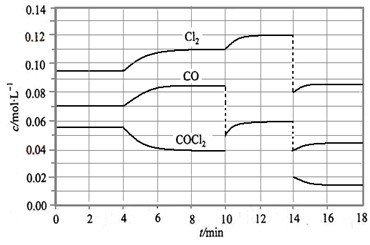
 Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如大图(每次仅改变一个条件):
Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如大图(每次仅改变一个条件):①比较第2 min 反应温度T(2)与第8 min反应温度T(8)的高低:T(2) T(8)
②比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率
[分别以v(2~3)、v(5~6)、v(12~13)表示]的大小
③比较第14min时,使平衡移动采取措施可以是
④比较第8 min和第16min时,平衡常数K值(分别用K8,K16表示)大小关系是
⑤COCl2在达平衡时的转化率中最大的是第 min(范围)
⑥计算出第4min之后再达平衡的混合气体中,平均相对分子质量最大数值是

①T(2)<T(8) ②v(2~3) > v(5~6) = v(12~13) ③体系减小压强
④K8等于K16 ⑤16分钟以后 ⑥60.2
④K8等于K16 ⑤16分钟以后 ⑥60.2
:此题中挡题。但不易得分,这主要体现在计算麻烦上。
①根据平衡常数K的计算公式可求出T(2)时的K值很明显小于T(8)时的K值。由于正反应是吸热反应,所以升高温度平衡向正反应方向进行,因此T(2)<T(8)。
②因为5~6分钟时,CO浓度再改变,所以平均反应速率大于其它的。因为反应处于平衡状态,根据反应速率的的计算公式可知,2~3、12~13时的平均反应速率为均为0。
③反应在第14min时,物质的浓度同时突然减小,然后反应物的浓度又逐渐减小,而生成物的浓度逐渐再增大,这么说改变的条件是容器容积变大即体系压强减小。
④由于在K8和K16时,温度是相同的,所以K8时的平衡常数等于K16时的平衡常数。
⑤由于反应达到平衡之后,改变条件时,平衡始终是向正反应方向进行的,所以转化率最大的应该是16min以后。
⑥根据图像可知,第4min之后再达平衡的混合气体中氯气、CO、光气的浓度分别是0.11mol/L、0.085mol/L和0.04mol/L。假设容器容积是1L,则混合气的平均相对分子质量是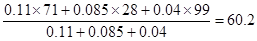
①根据平衡常数K的计算公式可求出T(2)时的K值很明显小于T(8)时的K值。由于正反应是吸热反应,所以升高温度平衡向正反应方向进行,因此T(2)<T(8)。
②因为5~6分钟时,CO浓度再改变,所以平均反应速率大于其它的。因为反应处于平衡状态,根据反应速率的的计算公式可知,2~3、12~13时的平均反应速率为均为0。
③反应在第14min时,物质的浓度同时突然减小,然后反应物的浓度又逐渐减小,而生成物的浓度逐渐再增大,这么说改变的条件是容器容积变大即体系压强减小。
④由于在K8和K16时,温度是相同的,所以K8时的平衡常数等于K16时的平衡常数。
⑤由于反应达到平衡之后,改变条件时,平衡始终是向正反应方向进行的,所以转化率最大的应该是16min以后。
⑥根据图像可知,第4min之后再达平衡的混合气体中氯气、CO、光气的浓度分别是0.11mol/L、0.085mol/L和0.04mol/L。假设容器容积是1L,则混合气的平均相对分子质量是

练习册系列答案
相关题目
 CH3OH(g).
CH3OH(g).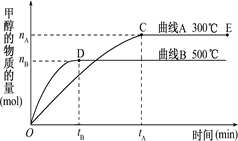
 2C(g);△H>0。下列反应条件有利于生成C的是( )
2C(g);△H>0。下列反应条件有利于生成C的是( )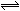 CO2(g) +H2(g);△H=-43kJ·mol-1对于此反应,下列措施中能提高CO转化率的是
CO2(g) +H2(g);△H=-43kJ·mol-1对于此反应,下列措施中能提高CO转化率的是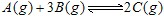 达到平衡的标志的是:
达到平衡的标志的是: 2NH3,当在某一温度下达到化学平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率?
2NH3,当在某一温度下达到化学平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率?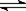 z C(g)+ w D(g)的平衡体系,当升高温度时,体系的压强降低,下列说法中正确的是( )
z C(g)+ w D(g)的平衡体系,当升高温度时,体系的压强降低,下列说法中正确的是( ) 2Z,其平衡常数为1600
2Z,其平衡常数为1600 2C(g)在固定容积的密闭容器中进行。若向容器中充入1molA和1molB,在T℃达平衡时,C的体积分数为m%;若向容器中充入2molC,T℃达平衡时,C的体积分数为n%;若向容器中充入1molC,T℃达平衡时,C的体积分数为p%。则m、n、p的关系是
2C(g)在固定容积的密闭容器中进行。若向容器中充入1molA和1molB,在T℃达平衡时,C的体积分数为m%;若向容器中充入2molC,T℃达平衡时,C的体积分数为n%;若向容器中充入1molC,T℃达平衡时,C的体积分数为p%。则m、n、p的关系是