题目内容
(10分)(1)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO)∶ CO(g)+2H2(g) CH3OH(g).
CH3OH(g).
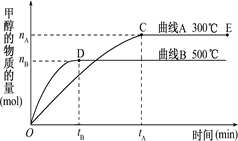
根据题意和所给图象完成下列各题:
①反应达到平衡时,平衡常数表达式K= ,
②升高温度,K值 (填“增大”“减小”或“不变”)
(2)一定温度下,将3 mol A气体和1 mol B气体通入一密闭容器中,发生如下反应:3A(g) + B(g) xC(g) 请填写下列空白:若容器体积固定为2 L,反应2 min时测得剩余0.6 mol B,C的浓度为0.4 mol/L。
xC(g) 请填写下列空白:若容器体积固定为2 L,反应2 min时测得剩余0.6 mol B,C的浓度为0.4 mol/L。
①x=
②平衡混合物中,C的体积分数为50%,则B的转化率是______________。
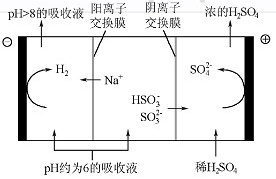
(3)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式 。
 CH3OH(g).
CH3OH(g).
根据题意和所给图象完成下列各题:
①反应达到平衡时,平衡常数表达式K= ,
②升高温度,K值 (填“增大”“减小”或“不变”)
(2)一定温度下,将3 mol A气体和1 mol B气体通入一密闭容器中,发生如下反应:3A(g) + B(g)
 xC(g) 请填写下列空白:若容器体积固定为2 L,反应2 min时测得剩余0.6 mol B,C的浓度为0.4 mol/L。
xC(g) 请填写下列空白:若容器体积固定为2 L,反应2 min时测得剩余0.6 mol B,C的浓度为0.4 mol/L。①x=
②平衡混合物中,C的体积分数为50%,则B的转化率是______________。
(3)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式 。
(10分)(1)①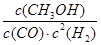 ②减小
②减小
(2)① 2 ②66.7﹪ (3)N2+8H++6e-=2NH4+
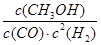 ②减小
②减小(2)① 2 ②66.7﹪ (3)N2+8H++6e-=2NH4+
试题分析:(1)①化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数表达式是K=
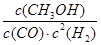 。
。②根据图像可知,温度越高,甲醇的含量越低。说明升高温度,平衡想逆反应方向越低,即正反应是放热反应,所以升高温度,K值减小。
(2)① 3A(g) + B(g)
 xC(g)
xC(g)起始浓度(mol/L) 1.5 0.5 0
转化浓度(mol/L) 0.6 0.2 0.2x
2min时浓度(mol/L) 0.9 0.3 0.2x
所以根据题意可知2x=0.4 mol/L
所以x=2
② 3A(g) + B(g)
 2C(g)
2C(g)起始浓度(mol/L) 1.5 0.5 0
转化浓度(mol/L) 3y y 2y
平衡浓度(mol/L) 1.5-3y 0.5-y 2y
所以根据题意可知
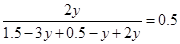
解得y=1/3
所以B的转化率是1/3÷0.5=66.67%
(3)原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应。所以氮气在正极通入。又因为电解质溶液显酸性,所以正极电极反应式是N2+8H++6e-=2NH4+。
点评:在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某深刻的量,然后依据已知条件列式计算即可。

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
 cZ(g),如图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强的关系示意图。
cZ(g),如图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强的关系示意图。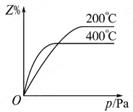
 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下: CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃时,K=1,今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列说法不正确的是( )
CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃时,K=1,今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列说法不正确的是( )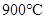 ,该反应的平衡常数
,该反应的平衡常数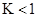
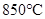 达到平衡时,通入CO,CO转化率将增大
达到平衡时,通入CO,CO转化率将增大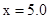 ,则起始时平衡向逆反应方向移动
,则起始时平衡向逆反应方向移动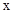 应满足
应满足
 CO2+H2;在827℃时的平衡常数是100,如果反应开始时,一氧化碳和水蒸气的浓度都是0.011mol/L,计算:一氧化碳在此反应条件下的平衡转化率。
CO2+H2;在827℃时的平衡常数是100,如果反应开始时,一氧化碳和水蒸气的浓度都是0.011mol/L,计算:一氧化碳在此反应条件下的平衡转化率。 2NO(g)+O2(g) △H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。
2NO(g)+O2(g) △H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。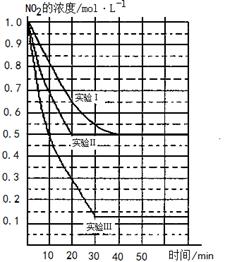
 SO3(g)+NO(g) △H>0,将NO2与SO2以体积比
SO3(g)+NO(g) △H>0,将NO2与SO2以体积比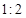 置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。 2AB(g)达到平衡状态的标志是( )
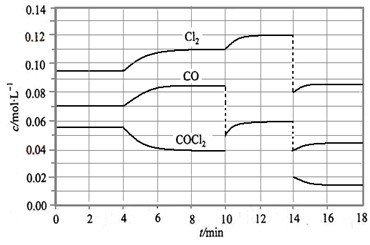
2AB(g)达到平衡状态的标志是( ) Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如大图(每次仅改变一个条件):
Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如大图(每次仅改变一个条件):