题目内容
将2molN2和8mol H2在适宜条件下按下式进行反应:N2+3H2 2NH3,当在某一温度下达到化学平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率?
2NH3,当在某一温度下达到化学平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率?
 2NH3,当在某一温度下达到化学平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率?
2NH3,当在某一温度下达到化学平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率?35%
考查可逆反应的有关计算,一般采用三段式。
N2+3H2 2NH3
2NH3
起始量(mol) 2 8 0
转化量(mol) x 3x 2x
平衡量(mol) 2-x 8-3x 2x
所以根据M=m/n可知
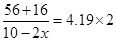
解得x=0.70
所以氮气的转化率是0.7÷2×100%=35%。
N2+3H2
 2NH3
2NH3起始量(mol) 2 8 0
转化量(mol) x 3x 2x
平衡量(mol) 2-x 8-3x 2x
所以根据M=m/n可知
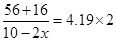
解得x=0.70
所以氮气的转化率是0.7÷2×100%=35%。

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案
相关题目
 CO2+H2;在827℃时的平衡常数是100,如果反应开始时,一氧化碳和水蒸气的浓度都是0.011mol/L,计算:一氧化碳在此反应条件下的平衡转化率。
CO2+H2;在827℃时的平衡常数是100,如果反应开始时,一氧化碳和水蒸气的浓度都是0.011mol/L,计算:一氧化碳在此反应条件下的平衡转化率。 2SO2(g)+ O2 (g)下列有关说法正确的是
2SO2(g)+ O2 (g)下列有关说法正确的是
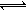 Si(s)+4HCl(g)△H=+236kJ/mol,将一定量反应物通入密闭容器进行以上可逆反应,既能提高SiCl4的转化率又能缩短达到平衡的时间的是
Si(s)+4HCl(g)△H=+236kJ/mol,将一定量反应物通入密闭容器进行以上可逆反应,既能提高SiCl4的转化率又能缩短达到平衡的时间的是 Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如大图(每次仅改变一个条件):
Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如大图(每次仅改变一个条件):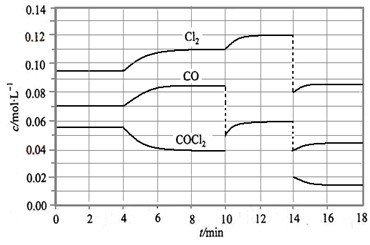
 2SO3,下列叙述能够说明反应已经达到平衡状态的是( )
2SO3,下列叙述能够说明反应已经达到平衡状态的是( )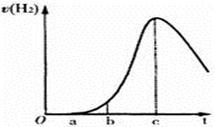
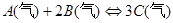 的下列叙述中不能说明反应已达到平衡的是( )
的下列叙述中不能说明反应已达到平衡的是( )