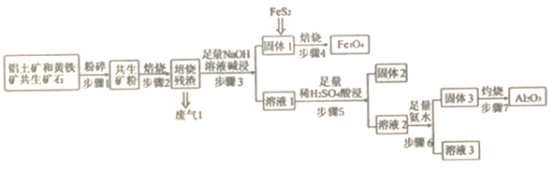
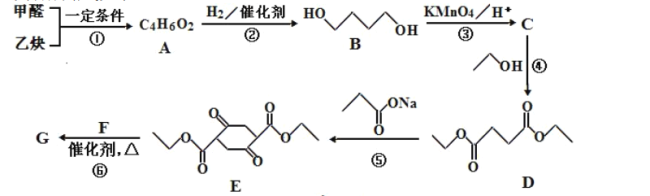
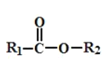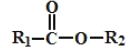题目内容
【题目】120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴入后者,还是将后者滴入前者,都有气体产生,但最终生成的气体体积不同,且比值为5:2,则盐酸的浓度是( )
A.2.0mol/LB.1.0mol/LC.0.18mol/LD.1.25mol/L
【答案】D
【解析】
当碳酸钠滴入盐酸中时发生CO32-+2H+═H2O+CO2↑,
当盐酸滴入碳酸钠溶液时,反应顺序为CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,都有气体产生,说明HCl的物质的量应大于Na2CO3的物质的量,又因为最终生成的气体体积不同,当碳酸钠滴入盐酸中时碳酸钠有剩余,当盐酸滴入碳酸钠溶液时,第一步反应完全,第二步反应碳酸氢根离子有剩余。
设HCl为nmol;当碳酸钠滴入盐酸中时发生CO32-+2H+═H2O+CO2↑反应,生成CO2的物质的量为![]() mol;当盐酸滴入碳酸钠溶液时,反应顺序为CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,发生CO32-+H+═HCO3-反应消耗盐酸0.2mol,发生HCO3-+H+═H2O+CO2↑反应,消耗盐酸(n-0.2)mol,所以生成CO2的物质的量为(n-0.2)mol,则
mol;当盐酸滴入碳酸钠溶液时,反应顺序为CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,发生CO32-+H+═HCO3-反应消耗盐酸0.2mol,发生HCO3-+H+═H2O+CO2↑反应,消耗盐酸(n-0.2)mol,所以生成CO2的物质的量为(n-0.2)mol,则![]() :(n-0.2)=5:2,n=0.25,盐酸的浓度是
:(n-0.2)=5:2,n=0.25,盐酸的浓度是![]() 1.25mol/L,故选D。
1.25mol/L,故选D。

【题目】铁(Fe)、铜(Cu)、银(Ag)是常见的金属元素,它们的单质及其化合物在生活中有广泛应用。
(1)Ag 与 Cu 在同一族,则 Ag 在周期表中________ (填“s”、“p”、“d”或“ds”)区;[Ag(NH3)2]+中 Ag+空的 5s 轨道和 5p 轨道以sp 杂化成键,则该配离子的空间构型是________。
(2)基态 Cu+的简化电子排布式为________。
(3)表中是 Fe 和 Cu 的部分电离能数据:请解释 I2(Cu)大于 I2(Fe)的主要原因:________。
元素 | Fe | Cu |
第一电离能 I1/kJ·mol-1 | 759 | 746 |
第二电离能 I2/kJ·mol-1 | 1561 | 1958 |
(4)亚铁氰化钾是食盐中常用的抗结剂,其化学式为 K4[Fe(CN)6]。
①CN-的电子式是________;1mol 该配离子中含σ 键数目为________。
②该配合物中存在的作用力类型有________ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(5)氧化亚铁晶体的晶胞结构如图所示。已知:
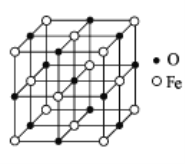
氧化亚铁晶体的密度为 ρgcm﹣3,NA代表阿伏加德罗常数的值。在该晶胞中,与 Fe2+紧邻且等距离的 Fe2+数目为________,Fe2+与O2﹣最短核间距为________pm。