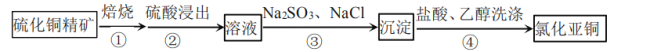题目内容
【题目】某铝土矿和黄铁矿的共生矿(主要成分为Al2O3、FeS2和SiO2),由此矿石制备Fe3O4和Al2O3的流程如下图所示,回答下列问题:
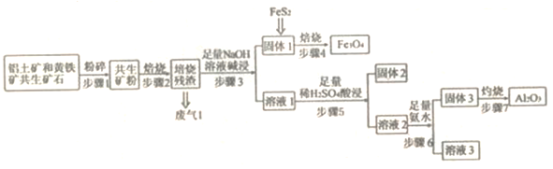
(1)“步骤2”焙烧过程产生的废气为 _________。
(2)已知“步骤4”隔绝空气焙烧,则化学方程式为________(已知该过程产生的废气和废气1成分相同)。
(3)“固体2”的成分是_________,步骤5的分离方法是_________。
(4)写出步骤5的离子方程式__________。
(5)若原矿石质量为bkg,经过该过程获得的Fe3O4的质童为akg,则原矿石中铁元素的质量分数为________。
(6)该流程中存在较为明显的缺陷是____________。
【答案】二氧化硫 FeS2+ 16Fe2O3![]() 11Fe3O4+2SO2↑ 硅酸 过滤 AlO2-+4H+=Al3++2H2O、SiO32-+2H+=H2SiO3↓
11Fe3O4+2SO2↑ 硅酸 过滤 AlO2-+4H+=Al3++2H2O、SiO32-+2H+=H2SiO3↓ ![]() 产生有害气体,污染环境;多次焙烧或灼烧,能耗高
产生有害气体,污染环境;多次焙烧或灼烧,能耗高
【解析】
铝土矿和黄铁矿的混合物焙烧是黄铁矿反应生成Fe2O3和SO2,加入足量的NaOH溶液,氧化铝和SiO2溶解得到“溶液1”为NaAlO2和Na2SiO3,“固体1”为Fe2O3,“溶液1”加入足量的稀硫酸,得到“固体2”为硅酸,可以用来制备纯硅,“溶液2”为硫酸铝,加入足量的氨水反应生成Al(OH)3,灼烧得到Al2O3,据此分析作答;
铝土矿和黄铁矿的混合物焙烧是黄铁矿反应生成Fe2O3和SO2,加入足量的NaOH溶液,氧化铝和SiO2溶解得到“溶液1”为NaAlO2和Na2SiO3,“固体1”为Fe2O3,“溶液1”加入足量的稀硫酸,得到“固体2”为硅酸,可以用来制备纯硅,“溶液2”为硫酸铝,加入足量的氨水反应生成Al(OH)3,灼烧得到Al2O3,
(1)根据共生矿中含有成分,“步骤2”发生的反应是4FeS2+11O2 ![]() 2Fe2O3+8SO2,即产生的废气为SO2;
2Fe2O3+8SO2,即产生的废气为SO2;
(2)根据上述分析,固体1为Fe2O3,因此“步骤4”反应过程中废气与废气1成分相同,即该过程中产生SO2,即该反应方程式是FeS2+16Fe2O3 ![]() 11Fe3O4+2SO2↑;
11Fe3O4+2SO2↑;
(3)根据“固体2”的成分是硅酸;步骤5得到固体和溶液,即该操作步骤是过滤;
(4)根据上述分析,“溶液1”的成分是NaAlO2和Na2SiO3,加入足量的稀硫酸,则发生的离子方程式为AlO2-+4H+=Al3++2H2O、SiO32-+2H+=H2SiO3↓;
(5)“步骤4”发生的反应是FeS2+16Fe2O3 ![]() 11Fe3O4+2SO2↑,则原矿石中铁元素的质量为
11Fe3O4+2SO2↑,则原矿石中铁元素的质量为![]() ,铁元素的质量分数为
,铁元素的质量分数为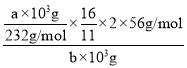 ×100%=
×100%=![]() ×100%;
×100%;
(6)流程中产生SO2等有害气体,污染环境,多次焙烧或灼烧,耗能高, 因此该流程中存在较为明显的缺陷是产生有害气体,污染环境,多次焙烧或灼烧,耗能高。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案