题目内容
【题目】I.氢气在工业合成中应用广泛。
(1)通过下列反应可以制备甲醇
①CO(g)+2H2(g)=CH3OH(g) △H=-90.8kJ·mol-1
②CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41.3kJ·mol-1
请写出由CO2和H2制取甲醇的热化学方程式:______________________。
Ⅱ.CH4可以消除氮氧化物的污染,主要反应原理为
CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g) △H=-868.7kJ·mol-1
(2)在3.00L密闭容器中通入1 mol CH4和2 mol NO2,在一定温度下进行上述反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
反应时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
总压强P/×100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
由表中数据计算,0~4min内v(NO2)=___________,该温度下的平衡常数K=___________。
(3)在一恒容装置中通入一定量CH4和NO2,测得在相同时间内和不同温度下,NO2的转化率如下图。则下列叙述正确的是___________。

A 若温度维持在200℃更长时间,NO2的转化率将大于19%
B 反应速率b点的v(逆)>e点的(逆)
C 平衡常数:c点=d点
D b点反应未达到平衡
(4)利用氨气可以设计高能环保燃料电池,用该电池电解含有NO3-的碱性工业废水,在阴极产生N2。阴极的电极反应式为______________________;在标准状况下,当阴极收集到13.44LN2时,理论上消耗NH3的体积为___________。
(5)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在 NH4HCO3溶液中c(NH4+)___________c(HCO3-)(填“>”“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=___________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
NH3·H2O+H2CO3的平衡常数K=___________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
【答案】![]()
![]() 0.1mol·L-1·min-1 6.75 AD
0.1mol·L-1·min-1 6.75 AD ![]() 44.8L > 1.25×10-3
44.8L > 1.25×10-3
【解析】
(1)由盖斯定律计算可得;
(2)由题给数据建立三段式,依据压强之比等于物质的量比计算0~4min和平衡时各物质的物质的量,运用化学反应速率和化学平衡常数公式计算;
(3)由图可知,温度400℃、500℃转化率最大,反应达到平衡状态,400℃之前反应没有到达平衡状态,该反应为放热反应,500℃之后升高温度,平衡向逆反应方向移动,NO2的转化率降低;
(4)由题给信息可知,NO2-在阴极上得电子发生还原反应生成N2;由得失电子数目守恒计算理论上消耗NH3的体积;
(5)由电离常数大小判断溶液中HCO3-和NH4+的水解程度;找出化学平衡常数与水的离子积常数和电离常数的关系计算。
(1)由盖斯定律可知,①+②得CO2和H2制取甲醇的热化学方程式CO2(g)+3H2(g)= CH3OH(g)+H2O(g),△H=△H1+△H2=(-90.8kJ·mol-1)+(+41.3kJ·mol-1)=-49.5kJ·mol-1,故答案为:CO2(g)+3H2(g)= CH3OH(g)+H2O(g)△H=-49.5kJ·mol-1;
(2)设0~4min内CH4的消耗量为x,由题意建立如下三段式:
CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g)
CO2(g)+2H2O(g)+N2(g)
起(mol) 1 2 0 0 0
变(mol) x 2x x 2x x
4min(mol)1—x 2—2x x 2x x
由![]() =
=![]() 得关系式
得关系式![]() =
=![]() ,解得x=0.6mol,则0~4min内v(NO2)=
,解得x=0.6mol,则0~4min内v(NO2)=![]() =
=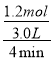 =0.1mol·L-1·min-1;由表中数据可知,8min时反应达到平衡,设CH4的消耗量为y,由题意建立如下三段式:
=0.1mol·L-1·min-1;由表中数据可知,8min时反应达到平衡,设CH4的消耗量为y,由题意建立如下三段式:
CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g)
CO2(g)+2H2O(g)+N2(g)
起(mol) 1 2 0 0 0
变(mol) y 2y y 2y y
平(mol) 1—y 2—2y y 2y y
由![]() =
=![]() 得关系式
得关系式![]() =
=![]() ,解得y=0.75mol,平衡时c(CH4)、c(NO2)、c(CO2)、c(H2O)、c(N2)分别为
,解得y=0.75mol,平衡时c(CH4)、c(NO2)、c(CO2)、c(H2O)、c(N2)分别为![]() mol/L、
mol/L、![]() mol/L、
mol/L、![]() mol/L、
mol/L、![]() mol/L、
mol/L、![]() mol/L,则化学平衡常数K=
mol/L,则化学平衡常数K=![]() =
=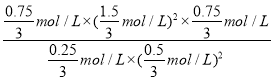 =6.75,故答案为:0.1mol·L-1·min-1;6.75;
=6.75,故答案为:0.1mol·L-1·min-1;6.75;
(3)A、图中200℃时,反应没有到达平衡,向正反应进行,温度维持在200℃更长时间,NO2的转化率将大于19%,故正确;
B、温度越高,化学反应速率越大,由图可知b点反应温度低于e点反应温度,则b点的v (逆) <e点的v (逆),故错误;
C、该反应为放热反应,升高温度,平衡向逆反应方向移动,化学平衡常数减小,由图可知c点反应温度低于d点反应温度,则化学平衡常数c>d,故错误;
D、由图可知,温度400℃、500℃转化率最大,反应达到平衡状态,400℃之前反应没有到达平衡状态,则b点反应未达到平衡,故正确;
AD正确,故答案为:AD;
(4)由题给信息NO3-→N2可知,N元素化合价由+3价→0价,NO2-在阴极上得电子发生还原反应生成N2,电极反应式为2NO3-+6H2O+10e-=N2↑+12OH-;标况下,13.44LN2的物质的量为![]() =0.6mol,NH3在阳极上失电子发生氧化反应生成N2,由得失电子守恒可得n(NH3)×3=n(N2)×10,解得n(NH3)=2mol,体积为2mol×22.4L/mol=44.8L,故答案为:2NO3-+6H2O+10e-=N2↑+12OH-;44.8;
=0.6mol,NH3在阳极上失电子发生氧化反应生成N2,由得失电子守恒可得n(NH3)×3=n(N2)×10,解得n(NH3)=2mol,体积为2mol×22.4L/mol=44.8L,故答案为:2NO3-+6H2O+10e-=N2↑+12OH-;44.8;
(5)由NH3.H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7可知在溶液中NH3.H2O的电离大于H2CO3的电离,则溶液中HCO3-的水解程度大于NH4+,所以NH4HCO3溶液中c(NH4+) 大于c(HCO3-);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=![]() =
=![]() =
=![]() ==1.25×10-3,故答案为:>;1.25×10-3。
==1.25×10-3,故答案为:>;1.25×10-3。