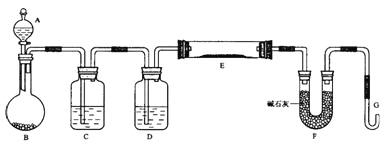
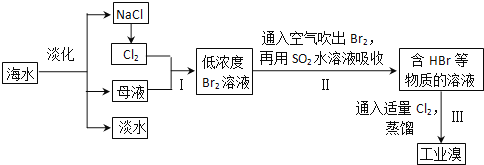
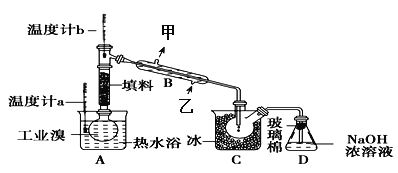
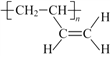
题目内容
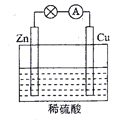
【题目】常温下,向20mL 浓度均为0.1mol/L (NH4)2SO4、NH4HSO4混和溶液中滴加0.1mol/L的Ba(OH)2溶液。充分反应后静置,溶液的pH 与所加Ba(OH)2溶液体积的关系如右图,下列说法正确的是

A. a点溶液中: c(NH4+) +c(NH3·H2O)=0.2 mol/L
B. b点溶液中: c(NH4+)>c(SO42-)>c(H+)> c(NH3·H2O)> c(OH-)
C. c点溶液中: c(Ba2+)+ c(NH4+)= c(SO42-)
D. d 点溶液中: c(NH3·H2O)> c(SO42-)>c(NH4+)> c(OH-)> c(H+)
【答案】B
【解析】A. 根据物料守恒可知,a点溶液中:c(NH4+)+c(NH3·H2O)=0. 3mol/L,选项A错误;B、b点溶液中:NH4HSO4与Ba(OH)2溶液反应:2NH4HSO4+Ba(OH)2=2H2O+(NH4)2SO4+ BaSO4↓,故溶液相当于![]() (NH4)2SO4溶液,溶液水解呈酸性,则c(NH4+)>c(SO42-)>c(H+)> c(NH3·H2O)>c(OH-),选项B正确;C、c点溶液中pH=7,c(H+)=c(OH-),根据电荷守恒有2c(Ba2+)+ c(NH4+)+ c(H+)=c(OH-)+2c(SO42-),则:2c(Ba2+)+ c(NH4+)= 2c(SO42-),选项C错误;D、根据所加溶液体积可知,若不考虑生成的氨水的电离和铵根离子的水解,得到的溶液中生成的一水合氨和铵根离子1:1,但溶液呈碱性,故电离大于水解,故c(NH4+)> c(NH3·H2O),选项D错误。答案选择B。
(NH4)2SO4溶液,溶液水解呈酸性,则c(NH4+)>c(SO42-)>c(H+)> c(NH3·H2O)>c(OH-),选项B正确;C、c点溶液中pH=7,c(H+)=c(OH-),根据电荷守恒有2c(Ba2+)+ c(NH4+)+ c(H+)=c(OH-)+2c(SO42-),则:2c(Ba2+)+ c(NH4+)= 2c(SO42-),选项C错误;D、根据所加溶液体积可知,若不考虑生成的氨水的电离和铵根离子的水解,得到的溶液中生成的一水合氨和铵根离子1:1,但溶液呈碱性,故电离大于水解,故c(NH4+)> c(NH3·H2O),选项D错误。答案选择B。

练习册系列答案
相关题目