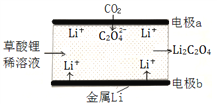
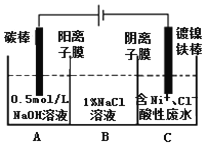
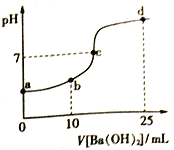
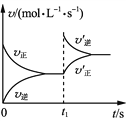
题目内容
【题目】将物质的量均为amol的FeCl3和CuCl2投人水中形成混合溶液,再加入bmol铁粉充分反应(忽略离子的水解),下列说法中不正确的是
A. 当b≥![]() 时,发生总反应的离子方程式为2Fe3++Cu2++2Fe=4Fe2++Cu
时,发生总反应的离子方程式为2Fe3++Cu2++2Fe=4Fe2++Cu
B. 当![]() <b<
<b<![]() 时,反应中转移电子的物质的量:amol<n(e-)<3amol
时,反应中转移电子的物质的量:amol<n(e-)<3amol
C. 当b≤![]() 时,发生的离子反应为2Fe3++Fe=3Fe2+
时,发生的离子反应为2Fe3++Fe=3Fe2+
D. 当![]() <b<
<b<![]() 元时,反应后的溶液中n(Cu2+):n(Fe2+)=(
元时,反应后的溶液中n(Cu2+):n(Fe2+)=(![]() -b):(b+a)
-b):(b+a)
【答案】A
【解析】本题采用带入数值讨论的方法进行分析:假设a=2 mol,b=3 mol;由于Fe3+根据反应发生的规律:先发生2Fe3++Fe=3Fe2+,后发生Cu2++ Fe = Cu+ Fe2+;2 molFe3+反应生成3 mol Fe2+,消耗1 mol Fe;2 mol Cu2+反应生成2 mol Fe2+,消耗2mol Fe;两个反应共消耗铁3 mol,当b≥3时,反应的总反应为:2Fe3++2Cu2++3Fe=5Fe2++2Cu;A错误;当 1<b<3之间,根据上述两个反应看出,转移电子数2mol<n(e-)<6mol,所以当![]() <b<
<b<![]() 时,反应中转移电子的物质的量规律是对的,B正确;当b≤1时,只能发生铁还原铁离子的反应,C正确;假设b=1,发生2Fe3++Fe=3Fe2+,溶液中n(Fe2+)=3 mol,n(Cu2+)=2 mol;当b=3时,发生2Fe3++2Cu2++3Fe=5Fe2++2Cu反应,n(Fe2+)=5 mol,n(Cu2+)=0;所以当
时,反应中转移电子的物质的量规律是对的,B正确;当b≤1时,只能发生铁还原铁离子的反应,C正确;假设b=1,发生2Fe3++Fe=3Fe2+,溶液中n(Fe2+)=3 mol,n(Cu2+)=2 mol;当b=3时,发生2Fe3++2Cu2++3Fe=5Fe2++2Cu反应,n(Fe2+)=5 mol,n(Cu2+)=0;所以当![]() <b<
<b<![]() 元时,反应后的溶液中符合上述规律是对的,D正确;正确选项A。
元时,反应后的溶液中符合上述规律是对的,D正确;正确选项A。

 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案【题目】3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

反应结束后,先分离出甲醇,再加入乙醚,将获得的有机层(含少量氯化氢)进行洗涤,然后分离提纯得到产物。甲醇和3,5-二甲氧基苯酚的部分物理性质见下表,下列说法正确的是
物质 | 沸点/℃ | 熔点/℃ | 溶解性 |
甲醇 | 64. 7 | ﹣97.8 | 易溶于水 |
3,5-二甲氧基苯酚 | 172~175 | 33~36 | 易溶于甲醇、乙醚,微溶于水 |
A. 上述合成反应属于取代反应
B. 间苯三酚与苯酚互为同系物
C. 分离出甲醇的操作是结晶
D. 洗涤时可以用饱和Na2CO3溶液除氯化氢