��Ŀ����
����Ŀ����Դ���ִ���ᷢչ��֧��֮һ��
��1����ѧ��Ӧ�е������仯����Ҫ����Ϊ�����ı仯��
�����з�Ӧ�У����ڷ��ȷ�Ӧ����_________������ĸ����
a��Ba(OH)2��8H2O��NH4Cl��Ͻ���
b����������ʯ��ʯ
c���������ᷴӦ
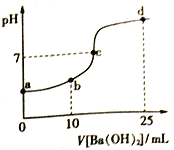
��ijͬѧ������ͼ��ʾʵ�飬����ϡ�������ռ���Һ�кͷ�Ӧ�������仯��ʵ���������Ӧ�¶����ߣ��ɴ��жϸ÷�Ӧ��_____________��������������������������Ӧ�������ӷ���ʽ��__________________________��
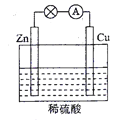
��2���������ִ����Ӧ����㷺����Դ֮һ����ͼ��ʾ��ԭ���װ���У�������____���������ܹ��۲쵽��������________�������ĵ缫��Ӧʽ��____________��ԭ��ع���һ��ʱ���������п6.5 g����ų�����_______g��
���𰸡� c ���� H++OH����H2O Zn ͭƬ���������ɫ���� 2H++2e����H2�� 0.2
��������
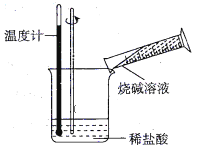
(1)�ٸ��ݳ����ķ��ȷ�Ӧ�У����е�ȼ�ա��������ᷴӦ��������ˮ��Ӧ���кͷ�Ӧ������������Ϸ�Ӧ�����ȷ�Ӧ�ȣ�
���кͷ�Ӧ�Ƿ��ȷ�Ӧ��
(2)���ݽ����Ļ����Ժ�ԭ���ԭ��������п��������������ͭ��������Һ�������ӵõ����ӷ�����ԭ��Ӧ�����������������ĵĽ��������ͷ���ʽ���㡣
(1)��a��Ba��OH��2��8H2O��NH4Cl��Ͻ������ڳ��������ȷ�Ӧ��a����
b��̼��Ƹ��·ֽ�������ƺͶ�����̼�ķ�Ӧ�����ȷ�Ӧ��b����
c���������ᷴӦ�������û���Ӧ������������ԭ��Ӧ����Ӧ�����з��ȣ�c��ȷ��
��ѡc��
���кͷ�Ӧ�Ƿ��ȷ�Ӧ�����ӷ���ʽΪH++OH����H2O��
(2)��Ϊп��ͭ���ã�����п�����������ĵĽ���Ϊп��пʧ��������п���ӽ�����Һ���缫��ӦʽΪZn-2e-��Zn2+��ͭƬ�������ӵõ����������������Ե缫��ӦʽΪ2H++2e����H2����ԭ��ع���һ��ʱ���������п6.5g�����ʵ���n(Zn)=6.5g��65g/mol=0.1mol�����ݷ�ӦZn+2H+��H2��+Zn2+��֪�ų�������Ϊ0.1mol������������Ϊ0.2g��

 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д� ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�����Ŀ���±��dz�����ijЩһԪ����ĵ��볣����
���� | HCN | HF | CH3COOH | HNO2 |
���볣�� | 6.2��10��10 | 6.8��10��4 | 1.7��10��5 | 6.4��10��6 |
��0.1 mol��L��1��������Һ�У�pH��С���ǣ� ��
A. HCN B. HF C. CH3COOH D. HNO2
����Ŀ��3��5-����������������Ҫ���л��ϳ��м��壬��������Ȼ���ʰ������صĺϳɡ�һ���Լ䱽����Ϊԭ�ϵĺϳɷ�Ӧ���£�

��Ӧ�������ȷ�����״����ټ������ѣ�����õ��л��㣨�������Ȼ��⣩����ϴ�ӣ�Ȼ������ᴿ�õ�����״���3��5-�����������ӵIJ����������ʼ��±�������˵����ȷ����
���� | �е�/�� | �۵�/�� | �ܽ��� |
�״� | 64. 7 | ��97.8 | ������ˮ |
3��5-������������ | 172~175 | 33~36 | �����ڼ״������ѣ�����ˮ |
A. �����ϳɷ�Ӧ����ȡ����Ӧ
B. �䱽�����뱽�ӻ�Ϊͬϵ��
C. ������״��IJ����ǽᾧ
D. ϴ��ʱ�����ñ���Na2CO3��Һ���Ȼ���