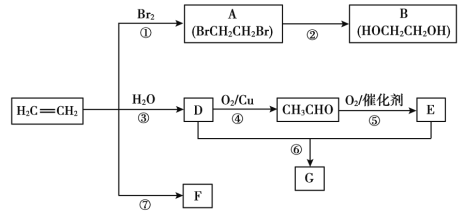
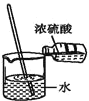
题目内容
【题目】已知①Na2O2②O2③HClO④H2O2⑤Cl2⑥NaClO⑦O3七种物质都具有强氧化性。请回答下列问题:
(1)上述物质中互为同素异形体的是_____(填序号,下同)。
(2)含非极性键的共价化合物是_____。
(3)属于离子化合物的有_____种。
(4)Na2O2、HCIO、H2O2均能用于制备O2。
①HClO在光照条件下分解生成O2和HCl,用电子式表示HCl的形成过程_____。
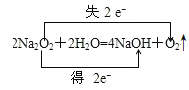
②写出Na2O2与H2O反应的方程式并标出电子转移方向和数目_____。
③H2O2在二氧化锰催化作用下可以制备O2。若6.8gH2O2参加反应,则转移电子数目为_____,生成标准状况下O2体积为_____L。
【答案】②⑦ ④ 2 ![]()
 1.204×1023或0.2NA 2.24
1.204×1023或0.2NA 2.24
【解析】
①Na2O2为离子化合物,含有离子键和非极性键;
②O2为非金属单质,只含有非极性键;
③HClO为共价化合物,含有极性键;
④H2O2为共价化合物,含有极性键和非极性键;
⑤Cl2为非金属单质,只含有非极性键;
⑥NaClO为离子化合物,含有离子键和极性键;
⑦O3为非金属单质,只含有非极性键;
(1)由同种元素组成的不同的单质互为同素异形体,O2与O3是氧元素形成的不同单质,互为同素异形体,故答案为:②⑦;
(2)由分析可知,含非极性键的共价化合物是H2O2,故答案为:④;
(3)由分析可知,七种物质中Na2O2和NaClO为离子化合物,共2种,故答案为:2;
(4)①HCl是共价化合物,用电子式表示HCl的形成过程是:![]() ,故答案为:
,故答案为:![]() ;
;
②Na2O2与H2O反应生成氧气和氢氧化钠,反应的化学方程式为2Na2O2 +2H2O=4NaOH +O2↑,反应中生成1mol氧气,转移2mol电子,电子转移方向和数目可表示为 ,故答案为:
,故答案为: ;
;
③在二氧化锰做催化剂作用下,双氧水分解生成水和氧气,反应的化学方程式为2H2O2![]() O2↑+2H2O,由方程式可知,生成1mol氧气转移2mol电子,6.8g H2O2的物质的量为
O2↑+2H2O,由方程式可知,生成1mol氧气转移2mol电子,6.8g H2O2的物质的量为![]() =0.2mol,则反应生成0.1mol氧气,转移的电子的数目为0.1mol×2×6.02×1023mol-1=1.204x1023或0.2NA,标准状况下O2体积为0.1mol×22.4L·mol 1=2.24L,故答案为:1.204x1023或0.2NA;2.24。
=0.2mol,则反应生成0.1mol氧气,转移的电子的数目为0.1mol×2×6.02×1023mol-1=1.204x1023或0.2NA,标准状况下O2体积为0.1mol×22.4L·mol 1=2.24L,故答案为:1.204x1023或0.2NA;2.24。

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】标号为①~⑩的元素,在元素周期表中的位置如下:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)(填写元素符号)① _____③______⑤_____ ⑦_____
(2)①和④号元素形成的化合物的化学式________,用电子式表示其形成过程为__________。
(3)⑦和⑧号元素的最高价氧化物的水化物的碱性是: ______﹥_________ (填化学式)。⑨和⑩号元素的最高价氧化物的水化物的酸性是: ______ ﹥_________ (填化学式)。
(4)①、⑤、⑦号元素形成的一种化合物的电子式是________,在该化合物中既含有________键,又含有________键。