题目内容
【题目】下列有关离子晶体的数据大小比较不正确的是( )
A. 晶格能:NaF>NaCl>NaBr
B. 硬度:MgO>CaO>BaO
C. 熔点:NaF>MgF2>AlF3
D. 阴离子的配位数:CsCl>NaCl>CaF2
【答案】C
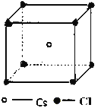
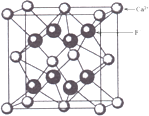
【解析】A、离子半径越小,所带电荷数越大,晶格能越大;B、根据原子半径大小比较键能,根据键能大小比较硬度;C、从离子半径以及电荷的角度比较晶格能,根据晶格能大小比较;D、根据NaCl、CsCl、CaF2的晶胞结构分别为: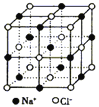 、
、 、
、 分析。
分析。
A、离子半径Br->Cl->F-,离子半径越小,所带电荷数越大,晶格能越大,故A正确;B、原子半径Ba>Ca>Mg,原子半径越大,键能越小,硬度越小,故B正确;C、离子半径Na+>Mg2+>Al3+,离子半径越小,电荷越多,晶格能越大,则熔点越高,故C错误;D、NaCl、CsCl、CaF2的晶胞结构分别为: 、
、 、
、 ,结合图可知,CsCl为立方体心结构,Cl-的配位数是8;在CaF2晶胞中每个Ca2+连接4个氟离子,但在下面一个晶胞中又连接4个氟离子,所以其配位数为8,在CaF2晶胞中每个F-连接4个钙离子,所以其配位数为4;NaCl为立方面向结构,钠离子的配位数为6,Cl-的配位数是6,则阴离子的配位数:CsCl>NaCl>CaF2,故D正确;故选C。
,结合图可知,CsCl为立方体心结构,Cl-的配位数是8;在CaF2晶胞中每个Ca2+连接4个氟离子,但在下面一个晶胞中又连接4个氟离子,所以其配位数为8,在CaF2晶胞中每个F-连接4个钙离子,所以其配位数为4;NaCl为立方面向结构,钠离子的配位数为6,Cl-的配位数是6,则阴离子的配位数:CsCl>NaCl>CaF2,故D正确;故选C。

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
【题目】下图是制取、洗涤并测量生成气体体积的装置示意图,利用上述装置进行下表所列实验,能达到试验目的是( )
物质实验 | a(液体) | b(固体) | c(液体) |
A | 稀盐酸 | 锌粒 | 浓H2SO4 |
B | 浓盐酸 | MnO2 | 浓H2SO4 |
C | 稀硫酸 | CaCO3 | 浓H2SO4 |
D | 浓氨水 | 生石灰 | 浓H2SO4 |

A. A B. B C. C D. D