��Ŀ����
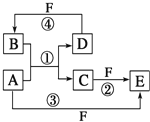
����Ŀ��BaCl2�����ڵ��ӡ��DZ��ȹ�ҵ���Զ���ʯ(��Ҫ�ɷ�ΪBaCO3����������CaCO3��MgSO4��Fe2O3��SiO2������)Ϊԭ�ϣ�ģ�ҵ��ȡBaCl2��2H2O����������ͼ��ʾ:

��֪:Ksp(BaC2O4)��1.6��10-7��Ksp(CaC2O4)��2.3��10-9
(1)�����ȡʱ��Ҫ�ʵ����ȵ�ԭ����_________��
(2)��37������������15�����������õ���������________(����ĸ)
A.��Ͳ B.�ձ� C.����ƿ D.������
(3)����I�ijɷ�Ϊ__________��
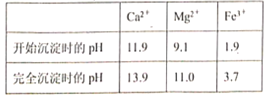
(4)Mg(OH)2���ܶȻ�����Ksp��_______������H2C2O4ʱ���������ӷ�ӦΪ_______������H2C2O4Ӧ�����������ԭ����_________��
(5)ĸҺ�г��˺���Ba2+��Cl���⣬�����д�����_________(�����ӷ���)��
(6)����III(�����ᾧˮ)�ǽ�ʯ����Ҫ�ɷ�����������ϴ�Ӹ�����ڿ����н������ط�����ȡ128.0g�ô������200��470�����գ����õ�100.0g���200��470��ʱ������Ӧ�Ļ�ѧ����ʽΪ___________��
���𰸡��ӿ췴Ӧ�ٶȣ���߽�ȡ�� ABD SiO2��BaSO4 1.0��10-11 Ca2++H2C2O4 = CaC2O4 ��+ 2H+ ��ֹ����BaC2O4 Na�� CaC2O4+O2 ![]() 2CaCO3+2CO2
2CaCO3+2CO2
��������
�������ȡ����ʯ(��Ҫ�ɷ�ΪBaCO3����������CaCO3��MgSO4��Fe2O3��SiO2������)��SiO2���ܣ���ȡҺ����Ba2+��Ca2+��Mg2+��Fe3+������Ba2+��SO42-����BaSO4����������I�ijɷ���SiO2��BaSO4����NaOH��Һ������Һ��pH=12.5������Mg2+��Fe3+������Ca2+�����˵õ�����IIΪMg(OH)2��Fe(OH)3��Ca(OH)2����ҺIII����Ba2+��Ca2+������������Ca2+������IIIΪCaC2O4������Һ����Ũ������ȴ�ᾧ�õ�BaCl22H2O���ݴ˷������
(1)�����ȡʱ�ʵ����ȣ����Լӿ췴Ӧ�ٶȣ���߽�ȡ�ʣ��ʴ�Ϊ���ӿ췴Ӧ�ٶȣ���߽�ȡ�ʣ�
(2)��37%����������15%���������õ�����������Ͳ���ձ������������ʴ�Ϊ��ABD��
(3)�����ȡ����ʯ(��Ҫ�ɷ�ΪBaCO3����������CaCO3��MgSO4��Fe2O3��SiO2������)��SiO2���ܣ���ȡҺ����Ba2+��Ca2+��Mg2+��Fe3+������Ba2+��SO42-����BaSO4����������I�ijɷ���SiO2��BaSO4���ʴ�Ϊ��SiO2��BaSO4��
(4)���ݱ������ݣ�þ���ӿ�ʼ������pH=9.1����ȫ����ʱ��pH=11.0����c(Mg2+)=1.0��10-5 mol/L����Ksp[Mg(OH)2]= 1.0��10-5��(1.0��10-3)2=1.0��10-11������H2C2O4����Ca2+����Ӧ�����ӷ���ʽΪCa2++H2C2O4 = CaC2O4 ��+ 2H+��Ϊ��ֹ����BaC2O4������H2C2O4ʱӦ����������ʴ�Ϊ��1.0��10-11��Ca2++H2C2O4 = CaC2O4 ��+ 2H+��Ϊ��ֹ����BaC2O4��
(5)BaCl2ĸҺ�г��˺���Ba2+��Cl-�⣬�����м�����NaOH��Һ���ʻ����д�����Na+���ʴ�Ϊ��Na+��
(6)128g CaC2O4�����ʵ���Ϊ1mol��200��470��ʱ������Ӧ������������Ϊ100g�����к���1molCa�����̼��Ƶ�Ħ������Ϊ100g/mol������֪���ù���Ϊ̼��ƣ��ٽ�Ϲ��������������������գ���֪����ƺ������ڸ����¼�����������̼��ƺͶ�����̼��������Ӧ�Ļ�ѧ����ʽΪ2CaC2O4+O2![]() 2CaCO3+2CO2���ʴ�Ϊ��2CaC2O4+O2
2CaCO3+2CO2���ʴ�Ϊ��2CaC2O4+O2![]() 2CaCO3+2CO2��
2CaCO3+2CO2��

 ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д� �����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д� Сѧ�����ҵ���ϴ�ѧ������ϵ�д�
Сѧ�����ҵ���ϴ�ѧ������ϵ�д� ���Ž�����ٰθ��νӹ㶫���������ϵ�д�
���Ž�����ٰθ��νӹ㶫���������ϵ�д� �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д�����Ŀ������������KMnO4��H2C2O4(����)��Ӧ�о�Ӱ�췴Ӧ���ʵ����أ����ӷ���ʽΪ2 MnO4-��5H2C2O4��6H+ = 2Mn2+��10CO2����8H2O��һʵ��С����ͨ���ⶨ��λʱ��������CO2�����ʣ�̽��ij��Ӱ�컯ѧ��Ӧ���ʵ����أ����ʵ�鷽������(KMnO4��Һ���ữ)��ʵ��װ����ͼ����ʾ��

ʵ����� | A��Һ | B��Һ |
�� | 20 mL 0.1 mol��L��1 H2C2O4��Һ | 30 mL 0.01 mol��L��1 KMnO4��Һ |
�� | 20 mL 0.2 mol��L��1 H2C2O4��Һ | 30 mL 0.01 mol��L��1 KMnO4��Һ |
(1)��ʵ��̽������_________________________________���ضԻ�ѧ��Ӧ���ʵ�Ӱ�졣
(2)��ʵ�����2 minĩ�ռ���4.48 mL CO2(��״����)������2 minĩ��c(MnO4-)��________ mol��L��1(��������Һ�����Ϊ50 mL)��
(3)С��ͬѧ���ַ�Ӧ���ʱ仯��ͼ�ң�����t1��t2ʱ�������ʱ�����Ҫԭ������ǣ�
�ٲ���Mn2���Ƿ�Ӧ�Ĵ�������_______________________________
���¶ȸ���500 Kʱ����ѧ�ҳɹ����ö�����̼�������ϳ����Ҵ������ڽ��ܼ��š�����̼�ŷŷ�������ش����塣�ش��������⣺
(1)�÷�Ӧ�Ļ�ѧ����ʽΪ___________________________________
(2)�ں��º����ܱ������У��ж�������Ӧ�ﵽƽ��״̬��������________________
a����ϵѹǿ���ٸı� b��H2��Ũ�Ȳ��ٸı�
c��������ܶȲ���ʱ��ı� d����λʱ��������H2��CO2�����ʵ���֮��Ϊ3��1