题目内容
【题目】铁是人类比较早使用的金属之一。完成下列问题:
Ⅰ.电子工业中用30%的FeCl3 溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程如图所示。

(1)FeCl3 溶液蚀刻铜箔反应的离子方程式为:___________________________;
(2)滤液中存在较多的阳离子是____________________;
(3)以下试剂也可以替代氯气完成转化,最好选用的是________(填序号)。
a.酸性KMnO4溶液 b.溴水 c.H2O2 溶液
Ⅱ.某氯化铁样品中含有少量FeCl2杂质,现要测定其中铁元素的质量分数,实验步骤如下:
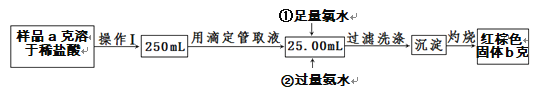
(4)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有_________________________(填仪器名称)。
(5)写出②加入过量氨水的离子方程式:_____________________。
(6)样品中铁元素的质量分数为________________。
(7)若沉淀灼烧不充分,对最终测量结果的影响:________________(填“偏大”“偏小”或“无影响”)。
【答案】2Fe3++Cu=2Fe2++Cu2+ Fe2+ c 250 mL容量瓶、胶头滴管 Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+ ![]() ×100% 偏大
×100% 偏大
【解析】
I.氯化铁溶液蚀刻铜箔所得废液中含有的金属离子有Fe2+、Fe3+和Cu2+,加入过量铁粉,溶液变为氯化亚铁溶液,过滤后的滤液通入足量氯气便可转化成氯化铁溶液,再经一系列分离操作可获得无水氯化铁;而固体为含有铁粉的铜,将铁粉除去便可获得铜单质。
II.要测定含氯化亚铁杂质的氯化铁样品中铁元素的质量分数,依据图示方法为:取一定质量的样品,先用足量的氯水氧化,再用过量氨水沉淀为氢氧化铁沉淀,过滤洗涤后的沉淀经灼烧最终转化成氧化铁,通过氧化铁的质量就可以计算出原样品中铁元素的质量分数。据此解答各小题。
I(1)氯化铁能将铜氧化:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+。
(2)由于废液中加入的铁粉是过量的,所以原溶液中的Cu2+和Fe3+均被还原,溶液中的金属阳离子只剩下Fe2+,故答案为:Fe2+。
(3)代替氯气将氯化亚铁氧化成氯化铁的物质不应带入杂质,所列三种物质均能将Fe2+氧化成Fe3+,但酸性高锰酸钾溶液和溴水均会带入杂质,而过氧化氢的还原产物水不是杂质,所以最好选用过氧化氢溶液,故答案为:c。
II(4)操作I是将溶液稀释成250mL,所用到的玻璃仪器有:250mL容量瓶、烧杯、玻璃棒、胶头滴管。故答案为:250mL容量瓶、胶头滴管。
(5)经氯水氧化后的溶液为氯化铁溶液,加氨水发生的反应为:Fe3++3NH3·H2O=Fe(OH)3↓+3![]() 。故答案为:Fe3++3NH3·H2O=Fe(OH)3↓+3
。故答案为:Fe3++3NH3·H2O=Fe(OH)3↓+3![]() 。
。
(6)bgFe2O3中铁的物质的量为:![]() =
=![]() mol,由于只取了250mL溶液中的25mL,所以,根据铁元素守恒,样品中铁元素的质量分数为:
mol,由于只取了250mL溶液中的25mL,所以,根据铁元素守恒,样品中铁元素的质量分数为: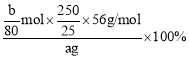 =
=![]() ×100%。故答案为:
×100%。故答案为:![]() ×100%。
×100%。
(7)氢氧化铁固体灼烧的反应为:2Fe(OH)3 ![]() Fe2O3+3H2O,灼烧过程中固体质量减少,如果灼烧不充分,会使所测氧化铁的质量偏高,从而使计算出的铁的含量偏大。故答案为:偏大。
Fe2O3+3H2O,灼烧过程中固体质量减少,如果灼烧不充分,会使所测氧化铁的质量偏高,从而使计算出的铁的含量偏大。故答案为:偏大。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案