题目内容
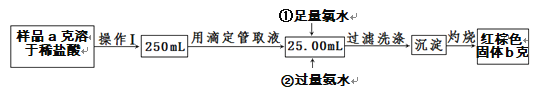
【题目】某化学课外活动小组拟用铅蓄电池为直流电源,进行电絮凝净水的实验探究,设计的实验装置如图所示。下列说法正确的是

A.Y电极反应为Pb+SO42--2e-=PbSO4
B.每消耗103.5gPb, 理论上电解池阴极上有1molH2生成
C.该电解池的总反应为2Al+6H2O![]() 2Al(OH)3+3H2↑
2Al(OH)3+3H2↑
D.若污水为含有Cr2O72-工业酸性废水,为将其转化为Cr3+除去,可让铁电极连接铅蓄电池的正极
【答案】D
【解析】
据图可知电解池中,铝电极失电子作阳极,电极反应为:2Al-6e-=2Al3+,在铝表面有氧气产生,说明有部分氢氧根离子放电,Fe电极上水得电子作阴极,电极反应为:6H2O+6e-=3H2↑+6OH-,铅蓄电池中X与阴极Fe相连,作负极,负极上发生的反应是Pb+SO42--2e-=PbSO4,Y与阳极铝相连,作正极,电极反应为PbO2+4H++SO42-+2e-=PbSO4+2H2O,串联电路中各电极转移电子相等。
A.由分析可知,Y作正极,电极反应为PbO2+4H++SO42-+2e-=PbSO4+2H2O,故A错误;
B.n(Pb)= ![]() ,Pb是+2价的金属,反应的Pb的物质的量是0.5mol,则反应转移电子的物质的量是0.5mol×2=1mol,根据串联电路中电子转移守恒,则电解池的阴极上反应产生H2的物质的量是0.5mol,故B错误;
,Pb是+2价的金属,反应的Pb的物质的量是0.5mol,则反应转移电子的物质的量是0.5mol×2=1mol,根据串联电路中电子转移守恒,则电解池的阴极上反应产生H2的物质的量是0.5mol,故B错误;
C.阳极铝电极反应为:2Al-6e-=2Al3+,阴极Fe电极电极反应为6H2O+6e-=3H2↑+6OH-,总反应为2Al+6H2O ![]() 2Al(OH)3(胶体)+3H2↑,在铝的表面有氧气产生,说明还存在电解水的过程:2H2O
2Al(OH)3(胶体)+3H2↑,在铝的表面有氧气产生,说明还存在电解水的过程:2H2O ![]() O2↑+2H2↑,故C错误;
O2↑+2H2↑,故C错误;
D.让铁电极连接铅蓄电池的正极作阳极,则铁失电子转化为亚铁离子,含有Cr2O72-工业酸性废水具有强氧化性,与亚铁离子反应可转化为Cr3+除去,故D正确;
综上所述,答案为D。

【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
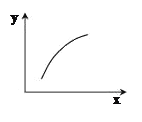
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |