题目内容
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:下列有关说法不正确的是
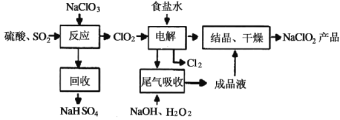
A.NaClO2中Cl的化合价+3价
B.“反应”步骤中生成ClO2的化学方程式2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4
C.“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为NaOH溶液和Na2CO3溶液
D.“尾气吸收”是吸收“电解”过程排出的少量ClO2,反应中,氧化剂与还原剂的物质的量之比为1:2
【答案】D
【解析】
由制备流程可知,NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO3是氧化剂,回收产物为NaHSO4,说明生成硫酸氢钠,且产生ClO2,根据得失电子守恒可知此反应的化学方程式;选择NaOH除去食盐水中的Mg2+,选择碳酸钠除去食盐水中的Ca2+,然后电解装置中阴极ClO2得电子生成ClO2-,阳极Cl-失电子生成Cl2,含过氧化氢的氢氧化钠溶液吸收ClO2,最后NaClO2溶液结晶、干燥得到产品,据此分析。
A.在NaClO2中Na为+1价,O为-2价,根据正负化合价的代数和为0,可得Cl的化合价为+3价,A正确;
B.NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO3是氧化剂,还原产物为NaCl,回收产物为NaHSO4,说明生成硫酸氢钠,且产生ClO2,根据得失电子守恒可知,此反应的化学方程式为:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4,B正确;
C.食盐中混有Mg2+和Ca2+,除去时需要加入的试剂分别为NaOH溶液和Na2CO3溶液,C正确;
D.依据图示可知,利用含过氧化氢的氢氧化钠溶液吸收ClO2,产物为NaClO2,则此反应中ClO2为氧化剂,还原产物为NaClO2,化合价从+4价降为+3价,H2O2为还原剂,氧化产物为O2,依据电子守恒可知氧化剂和还原剂的物质的量之比为2:1,D错误;
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
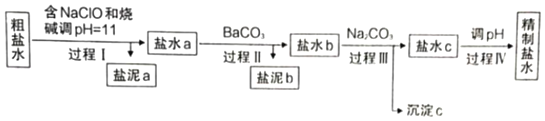
小学生10分钟应用题系列答案【题目】知识的梳理和感悟是有效学习的方法之一。山大附中高二化学兴趣小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(所有电极均为石墨)。电解所用的氯化钠溶液需精制,除去有影响的Ca2+、Mg2+、NH4+、SO42﹣及泥沙,其精制流程如下:
已知:①Ca2+、Mg2+开始形成相应氢氧化物沉淀的pH如表。
Ca(OH)2 | Mg(OH)2 | |
pH | ≥11.5 | ≥9.2 |
②Ksp(BaSO4)=1.1×10﹣10,Ksp(BaCO3)=2.6×10﹣9,Ksp(CaCO3)=5.0×10﹣9
(1)盐泥a除泥沙外,还含有___________(填化学式)。
(2)过程I中,NaClO的作用是将NH4+转化为N2,反应的离子方程式为________________。
(3)过程Ⅲ中,沉淀c主要成分的化学式为_____。
(4)过程Ⅳ调pH目的是除去___________(填离子符号)
(5)利用图1装置电解精制氯化钠一段时间后,气球b中的气体是_____(填化学式)
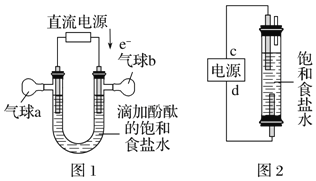
(6)利用图2制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分NaClO,则c为电源的_____极;该发生器中反应的总离子方程式为_______________。
(7)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。如图是目前已开发出用电解法制取ClO2的新工艺。
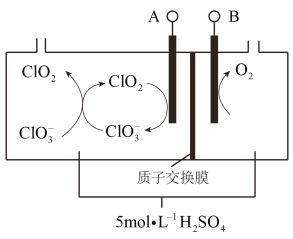
①阴极发生的反应有:_______________、__________________________。
②当阳极产生标准状况下112 mL气体时,通过阳离子交换膜离子的物质的量为_____。
【题目】研究金属腐蚀和防腐的原理很有现实意义.
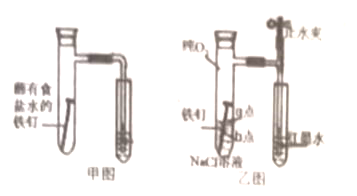
(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置,某兴趣小组按装置试验,导管中液柱的上升缓慢,为更快更清晰地观察到液柱上升的现象,下列措施错误的________(填序号)
A.用纯氧气代替试管内空气
B.用酒精灯加热试管提高温度
C.将铁钉换成铁粉和炭粉混合粉末
D.换成更细的导管,水中滴加红墨水
(2)为探究铁钉腐蚀实验a、b两点所发生的反应,张老师进行以下实验,证明铁发生电化学腐蚀。请完成表格空白:
实验操作 | 实验现象 | 实验结论 |
ⅰ.向NaCl溶液中滴加2~3滴酚酞指示剂 | a点附近溶液出现红色 | a点电极反应为_______________ |
ⅱ.然后再滴加2~3滴铁氰化钾溶液 | b点周围出现蓝色沉淀 | b点电极反应为_______________ 沉淀的化学式为______________ |
(3)孔老师认为仅通过b中现象不能证明铁发生了电化学腐蚀,补充进行下列实验,在实验几分钟后的记录如下:
实验 | 滴管 | 现象 |
1.0 mol·L-1NaCl溶液 | 0.5 molL﹣1K3[Fe(CN)6]溶液 | 铁片表面产生大量蓝色沉淀 |
以上实验表明,K3[Fe(CN)6]具有________性
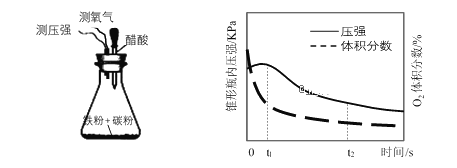
(4)赵老师设计下面装置研究弱酸性环境中腐蚀的主要形式,测定锥形瓶内气压和空气中氧气的体积分数随时间变化见图,从图中可分析,t1~t2之间主要发生_________腐蚀(填吸氧或析氢)
(5)金属阳极钝化形成保护膜是一种电化学防腐方法,将Fe作阳极置于H2SO4溶液中,一定条件下Fe表面形成致密Fe3O4氧化膜,试写出该阳极电极反应式_________。
【题目】某探究小组利用丙酮的溴代反应(CH3COCH3+Br2![]() CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 v(Br2) 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 v(Br2) 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
实验序号 | 初始浓度c/mol·L-1 | 溴颜色消失所需时间t/s | ||
CH3COCH3 | HCl | Br2 | ||
① | 0.80 | 0.20 | 0.0010 | 290 |
② | 1.60 | 0.20 | 0.0010 | 145 |
③ | 0.80 | 0.40 | 0.0010 | 145 |
④ | 0.80 | 0.20 | 0.0020 | 580 |
分析实验数据所得出的结论不正确的是( )
A.增大c(CH3COCH3),v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
D.增大c(Br2),v(Br2)增大