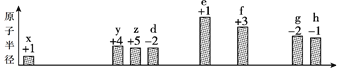
题目内容
【题目】乙炔是重要的化工原料,广泛用于有机合成和氧炔焊等。生产乙炔的方法有多种,如电石法、甲烷裂解法等。
(1)在Co(NO3)2催化下,乙炔可被50%的浓硝酸(硝酸被还原为NO2)在20~70℃时直接氧化为H2C2O4·2H2O。
①该反应的化学方程式为____________________________________________________;
②实际生产中硝酸可循环利用而不被消耗,用方程式说明:__________________。
(2)电石法原理为:由石油焦与生石灰在电炉中生成电石CaC2(含Ca3P2、CaS等杂质),电石与水反应生成C2H2(含PH3及H2S等杂质)。
①已知焦炭固体与氧化钙固体每生成l g CaC2固体,同时生成CO气体吸收7.25kJ的热量,则该反应的热化学方程式为______________________________________________;
②用CuSO4溶液净化乙炔气体,去除PH3的反应之一为:
4CuSO4+PH3+4H2O==4Cu↓+H3PO4+4H2SO4,每去除1 mol PH3,该反应中转移电子的物质的量为__________;
③电石法工艺流程简单、容易操作、乙炔纯度高,缺点是___________________(举1例)。
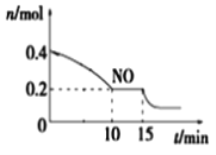
(3)甲烷裂解法原理为:2CH4(g)![]() C2H2(g)+3H2(g) △H,实验测得该反应的Kp(用平衡分压代替浓度计算的平衡常数,分压=总压×物质的量分数)与温度的关系如下图所示:
C2H2(g)+3H2(g) △H,实验测得该反应的Kp(用平衡分压代替浓度计算的平衡常数,分压=总压×物质的量分数)与温度的关系如下图所示:
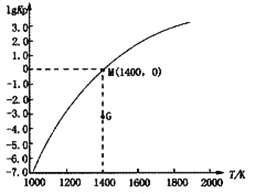
①该反应的△H________0(填“>”、“=”或“<”);
②图中G点v(正)______v(逆)(填“>”、“=”或“<”);
③M点时,若容器中气体的总物质的量为1 mol,CH4、C2H2及H2的物质的量分别为a、b、c,则总压P与a、b、c之间的关系为___________________。
【答案】C2H2+8HNO3=H2C2O4·2H2O+8NO2↑+2H2O 3NO2+H2O=2HNO3+NO,2NO+O2=2NO2 CaO(s)+3C(s)=CaC2(s)+CO(g) △H=+464kJ·mol-1 8mol 消耗大量的电能或污染严重 > > ![]()
【解析】
本题主要考查乙炔的工业制法。
(1)①该反应的化学方程式为C2H2+8HNO3![]() H2C2O4·2H2O+8NO2↑+2H2O;
H2C2O4·2H2O+8NO2↑+2H2O;
②实际生产中硝酸可循环利用而不被消耗,用方程式说明:3NO2+H2O=2HNO3+NO,2NO+O2=2NO2。
(2)①每生成64g CaC2固体吸收464kJ热量,则该反应的热化学方程式为CaO(s)+3C(s)=CaC2(s)+CO(g) △H=+464kJ·mol-1;
②4CuSO4+PH3+4H2O==4Cu↓+H3PO4+4H2SO4,PH3~8e-,每去除1 mol PH3,该反应中转移电子的物质的量为8mol;
③电石法工艺流程简单、容易操作、乙炔纯度高,缺点是消耗大量的电能或污染严重。
(3)①该反应的Kp随着温度升高而增大,可见升温平衡右移,该反应的△H>0;
②图中G点在一定温度下达到平衡的过程中,浓度商增大,所以v(正) >v(逆);
③M点时,若容器中气体的总物质的量为1 mol,CH4、C2H2及H2的物质的量分别为a、b、c,CH4、C2H2及H2的分压分别为aP、bP、cP,则Kp=![]() =1,所以总压P与a、b、c之间的关系为
=1,所以总压P与a、b、c之间的关系为![]() 。
。

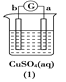
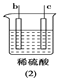
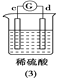
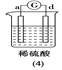
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
|
|
|
|
a极质量减小,b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A. d>a>b>cB. b>c>d>aC. a>b>c>dD. a>b>d>c