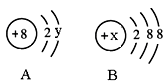题目内容
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O、NO+NO2+2NaOH=2NaNO2+H2O。则生成的盐溶液中NaNO3的物质的量为
| A.0.2 mol | B.0.4 mol | C.0.6 mol | D.0.8 mol |
A
试题分析:51.2gCu的物质的量=51.2g÷64g/mol=0.8mol,铜和硝酸反应铜还原硝酸生成氮氧化合物,在NaOH溶液中氮氧化合物又转化成NaNO3和NaNO2,则铜将失去的电子给了硝酸在氢氧化钠溶液中生成了NaNO2。其中氮元素的化合价从+5价降低到+3价,所以根据得失电子数目相等得到n(Cu)=n(NaNO2),因此n(NaNO2)=n(Cu)=0.8mol。氢氧化钠的物质的量=0.5L×2mol/L=1.0mol,则根据钠离子守恒可知,硝酸钠的物质的量=1.0mol-0.8mol=0.2mol,答案选A。

练习册系列答案
相关题目