题目内容
18.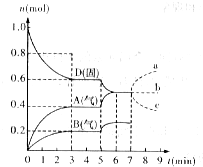 在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,据图回答下列问题:
在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,据图回答下列问题:(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为0.067mol/(L•min).
(2)根据右图写出该反应的化学方程式2D(s)?2A(g)+B(g).
(3)第5分钟时,升高温度,A、B、D的物质的量变化如图,则该反应是吸热(填“放热”或“吸热”)反应,若在第7分钟时增加D的物质的量,A的物质的量变化正确的是b(用图中a~c的编号回答)
分析 (1)根据V=$\frac{△c}{△t}$进行计算;
(2)根据各物质的增减判断反应物、生成物,根据同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比判断;
(3)根据温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动;增加固体的物质的量,浓度不变,平衡不移动.
解答 解:(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为$\frac{\frac{0.4mol}{2.0L}}{3min}$=0.067mol/L•min,
故答案为:0.067;
(2)根据图象知,随着反应的进行,D的物质的量减少,A、B的物质的量增加,所以D是反应物,A、B是生成物;同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比,0-3min时,△D=0.4mol,
△A=0.4mol,△B=0.2mol,△D:△A:△B=0.4mol:0.4mol:0.2mol=4:4:2,方程式为:2D(s)?2A(g)+B(g);
故答案为:2D(s)?2A(g)+B(g)
(3)温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动,说明正反应为吸热反应,
D为固体,增加D的物质的量,浓度不变,平衡不移动,故选:b;
故答案为:吸热;b.
点评 本题考查了化学平衡,平衡计算分析应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
9.不能用加氢还原的方法得到的醇是( )
| A. | CH3OH | B. | C2H5OH | C. | (CH3)2CHOH | D. | (CH3)3COH |
6.请根据实验目的填写简要的实验方法(包括使用的仪器、操作及现象).
| 序号 | 实验目的 | 实验方法 |
| ① | 检验混合气体N2和NH3中有NH3 | |
| ② | 除去NaCl和NH4Cl固体混合物中的杂质NH4Cl | |
| ③ | 观察铜与浓硫酸在试管中共热后产物溶液的颜色 |
3.下列各组离子在强碱性溶液中,可以大量共存的是( )
| A. | K+ Na+ HSO3- Cl- | B. | Na+ Ba2+[Al(OH)4]- NO3- | ||
| C. | NH4+ K+ Cl- NO3- | D. | Fe2+ Na+ ClO- S2- |
2.下列关于2760Co原子的叙述不正确的是( )
| A. | 中子数为33 | B. | 质量数为60 | C. | 质子数为60 | D. | 电子数为27 |