题目内容
10.在一定的温度和压强下体积比为2:3的乙烯和乙醇蒸汽的混合气体V L,将其完全燃烧时所需氧气的体积为3VL.分析 根据物质的组成判断耗氧量:烃CxHy的耗氧量取决于x+$\frac{y}{4}$,烃的含氧衍生物CxHyOz耗氧量取决于x+$\frac{y}{4}$-$\frac{z}{2}$,据此判断物质的量相同的乙烯与乙醇的耗氧量相同.
解答 解:乙烯分子式为C2H4,其耗氧量为:x+$\frac{y}{4}$=2+1=3,即1体积乙烯消耗3体积氧气;
乙醇的分子式为C2H6O,其于x+x+$\frac{y}{4}$-$\frac{z}{2}$=2+$\frac{6}{4}$-$\frac{1}{2}$=3,即1体积乙醇消耗3体积氧气,
所以混合气体中乙烯和乙醇的体积比混合,VL混合气体能够消耗3VL氧气,
故答案为:3VL.
点评 本题考查了混合物反应的计算,题目难度中等,明确等体积的乙烯和乙醇完全燃烧消耗氧气的量相同为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.在一定温度下,可逆反应X(g)+3Y(g)?2Z(g)达到反应限度的标志是( )
| A. | Z的生成速率和X的分解速率相等 | |
| B. | 单位时间内生成n molX,同时生成了3n molY | |
| C. | X、Y、Z的浓度不再变化 | |
| D. | X、Y、Z的分子个数之比为1:3:2 |
1.下列反应制取气体合理可行的是( )
| A. | Zn+2HNO3(稀)═Zn(NO3)2+H2↑ | |
| B. | CaCO3+H2SO4(稀)═CaSO4+H2O+CO2↑ | |
| C. | NH4Cl(aq)+NaOH(aq)═NaCl+H2O+NH3↑ | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O |
15.下列化合物不是离子化合物的是( )
| A. | SiO2 | B. | KHCO3 | C. | NH4Br | D. | NaOH |
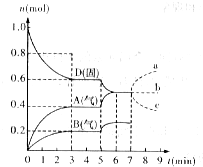 在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,据图回答下列问题:
在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,据图回答下列问题:
 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,如图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,如图为反应产生氢气速率与反应时间的关系图.