��Ŀ����
����Ŀ�����к͵ζ����ⶨij�ռ���Ʒ�Ĵ��ȣ��Ը���ʵ��ش��������⣺
��1��ȷ����8.2g �������������������ʵ���Ʒ�����500mL ������Һ����0.1000mol��L-1������ζ���д�����кͷ�Ӧ���Ȼ�ѧ����ʽ________________________________(�к��Ȧ�H=-57.3 kJ/mol)��
��2���ζ������У��۾�Ӧע��___________�����÷�̪��ָʾ���ﵽ�ζ��յ�ı�־��_____________��
��3�������±����ݣ������ռ���Ʒ�Ĵ�����___________���ðٷ�����ʾ������С�������λ��
�ζ����� | ������Һ�����mL�� | ������� | |
�ζ�ǰ�Ŀ̶ȣ�mL�� | �ζ���Ŀ̶ȣ�mL��) | ||
��һ�� | 10. 00 | 0. 40 | 20. 50 |
�ڶ��� | 10. 00 | 4. 10 | 24. 00 |
��4������ʵ�������Եζ��������ʲô��������ƫ�ߡ���ƫ�͡�����Ӱ�족��
�ٹ۲���ʽ�ζ���Һ��ʱ����ʼ���ӣ��ζ��յ�ƽ�ӣ���ζ����____________��
��������ƿ�ô���Һ��ϴ��Ȼ���ټ���10. 00mL����Һ����ζ����____________��
���𰸡� 2NaOH(aq)+H2SO4(aq)=2H2O(l)+Na2SO4 (aq) ��H= -114.6kJ��mol��1 ��ƿ����Һ��ɫ�仯 ���μ����һ�α�������Һʱ����Һ��dz��ɫ�����ɫ���Ұ�����ڲ��ָ�ԭɫ 97.56% ƫ�� ƫ��
��������(1)�������������Ʒ����кͷ�Ӧ���Ȼ�ѧ����ʽΪ2NaOH(aq) +H2SO4(aq)=2H2O(l) +Na2SO4 (aq) ��H= -114.6kJ��mol-1��
(2)�ڵζ������У��۾�Ӧע����ƿ����Һ��ɫ�ı仯���÷�̪��ָʾ���ﵽ�ζ��յ�������ǵμ����һ���������Һʱ����Һ����ɫ�ɷۺ�ɫ��Ϊ��ɫ�����ڰ�����ڲ��ָ�ԭɫ��
(3)�ɱ������ݿ�֪����Һ�����ƽ��ֵΪ20.00mL������10.00mL��c=20.00mL��0.1000mol/L��2�� c=0.4000mol/L����500mL��Һ��n(NaOH)=0.4000mol/L��0.5L= 0.2mol�������ռ���Ʒ�Ĵ���=![]()
(4)�ٹ۲���ʽ�ζ���Һ��ʱ����ʼ���ӣ�ʹ����ƫС���ζ��յ�ƽ�ӣ��������������Ա�Һ���������ʹ�ζ����ƫ�ߣ�����ƿ�ô���Һ��ϴ��ʹ����Һ���������������ı�Һ�������ʹ�ζ����ƫ�ߡ�

����Ŀ��ijʵ��С����H2O2�ֽ�Ϊ�����о�Ũ�ȡ���������Һ����ԶԷ�Ӧ���ʵ�Ӱ�죬�ڳ����°������·������ʵ�顣
ʵ���� | ��Ӧ�� | ���� |
�� | 10 mL 2% H2O2��Һ | �� |
�� | 10 mL 5% H2O2��Һ | �� |
�� | 10 mL 5% H2O2��Һ | 1 mL 0.1 mol L-1 FeCl3��Һ |
�� | 10 mL 5% H2O2��Һ+����HCl��Һ | 1 mL 0.1 mol L-1 FeCl3��Һ |
�� | 10 mL 5% H2O2��Һ+����NaOH��Һ | 1 mL 0.1 mol L-1 FeCl3��Һ |
��1�������ܼӿ컯ѧ��Ӧ���ʵ�ԭ������
��2��ʵ��ٺ͢ڵ�Ŀ������ʵ��ʱ���ڽϳ�ʱ��û�й۲쵽������������ó����ۡ�������ʾ��ͨ��������H2O2�ȶ������ֽ⡣Ϊ�˴ﵽʵ��Ŀ�ģ����ԭʵ�鷽���ĸĽ�����
��3��д��ʵ��۵Ļ�ѧ��Ӧ����ʽ����
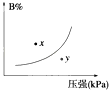
��4��ʵ��ۡ��ܡ����У�������������������ʱ��仯�Ĺ�ϵ��ͼ��������ͼ�ܹ��ó���ʵ���������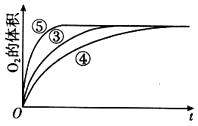
����Ŀ����1�����Ĺ̶��Ǽ���������ѧ��һֱ�о��Ŀ��� ��
�±��о��˲����¶��´����̵���ҵ�̵��IJ��ֻ�ѧƽ�ⳣ��K��ֵ��
��Ӧ | �����̵�N2(g)+O2(g) | ��ҵ�̵�N2(g)+3H2 (g) | |||
�¶�/�� | 27 | 2000�� | 25 | 400 | 450 |
K | 3.84��10��31 | 0.1 | 5��108 | 0.507 | 200 |
�ٷ������ݿ�֪�������̵���Ӧ����_____________ (����ȡ����ȡ���Ӧ��
�ڴ�ƽ���ӽǿ��ǣ���ҵ�̵�Ӧ��ѡ������������ʵ�ʹ�ҵ����ȴѡ��500�����ҵĸ��£�������ԭ��________________________________��
����һ�����¶Ⱥ�ѹǿ�£���2���N2��6���H2����һ�ݻ��ɱ���ܱ������У��������·�Ӧ��N2(g)+3H2(g)![]() 2NH3(g) ��H<0����Ӧ�ﵽƽ���N2����������Ϊa%��������ͬ�����г���m Ħ����N2��n Ħ����H2Ҳ��ʹƽ��ʱN2�����������ﵽa%����m ��n �Ĺ�ϵ�ô���ʽ����ӦΪ___________������һ���¶��µĶ����ܱ������з���������Ӧ����˵���˷�Ӧ�Ѵﻯѧƽ��״̬����________��
2NH3(g) ��H<0����Ӧ�ﵽƽ���N2����������Ϊa%��������ͬ�����г���m Ħ����N2��n Ħ����H2Ҳ��ʹƽ��ʱN2�����������ﵽa%����m ��n �Ĺ�ϵ�ô���ʽ����ӦΪ___________������һ���¶��µĶ����ܱ������з���������Ӧ����˵���˷�Ӧ�Ѵﻯѧƽ��״̬����________��
A.�ܶȲ��� B.�������ƽ����Է�����������
C.V��(N2)= 2v��(NH3) D.N2������������ٸı�
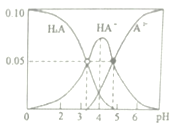
��2�������Ϊ10mL��pH��Ϊ2�Ĵ�����Һ��һԪ��HX��Һ�ֱ��ˮϡ����1000mL��ϡ����pH �仯��ͼ����HX �ĵ���ƽ�ⳣ��_________������ڡ��������ڡ���С�ڡ�������ĵ���ƽ�ⳣ����ϡ�ͺ�HX��Һ��ˮ���������c (H+)_______ ������ڡ��������ڡ���С�ڡ����������Һ��ˮ���������c (H+)��������_______________________________________��
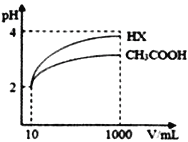
��3����֪100��ʱ��ˮ�����ӻ�����Ϊ1��10-12�������¶���pH=1��H2SO4��ҺaL��pH=11��NaOH��ҺbL��ϣ������û��ҺpH=2����a��b=________��