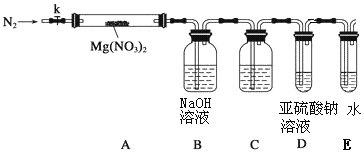
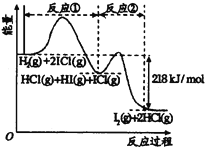
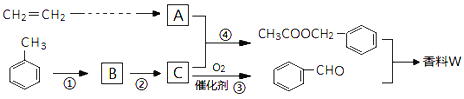
题目内容
【题目】Na、Al、Fe都是重要的金属元素。下列说法正确的是
A.氧化物都是碱性氧化物
B.氢氧化物都是白色固体
C.单质都可以与水反应
D.单质在空气中都形成致密氧化膜
【答案】C
【解析】
A.Na、Al、Fe的氧化物中,过氧化钠能跟酸起反应,除生成盐和水外,还生成氧气,不是碱性氧化物,氧化铝不但可以和碱反应还可以和酸反应均生成盐和水,为两性氧化物,故A错误;
B.氢氧化钠、氢氧化铝为白色固体,而氢氧化铁为红褐色固体,故B错误;
C.钠与水反应2Na+2H2O=2NaOH+H2↑,生成氢氧化钠和氢气,铁与水蒸汽反应生成氢气与四氧化三铁,3Fe+4H2O(g)![]() Fe3O4+4H2,在金属活动性顺序表中,铝介于二者之间,铝和水2Al+6H2O
Fe3O4+4H2,在金属活动性顺序表中,铝介于二者之间,铝和水2Al+6H2O![]() 2Al(OH)3+3H2↑,反应生成氢氧化铝和氢气,高温下氢氧化铝分解阻碍反应进一步进行,但铝能与水反应,故C正确;
2Al(OH)3+3H2↑,反应生成氢氧化铝和氢气,高温下氢氧化铝分解阻碍反应进一步进行,但铝能与水反应,故C正确;
D.Na在空气中最终生成碳酸钠,不是形成致密氧化膜,Al在空气中与氧气在铝的表面生成一层致密的氧化物保护膜,阻止Al与氧气的进一步反应,铁在空气中生成三氧化二铁,不是形成致密氧化膜,故D错误;
故答案为C。

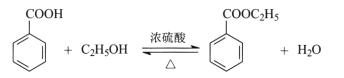
【题目】苯甲酸乙酯可由苯甲酸与乙醇在浓硫酸共热下反应制得,反应装置如图(部分装置省略),反应原理如下:
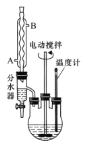
实验操作步骤:
①向三颈烧瓶内加入12.2g苯甲酸、25mL乙醇、20mL苯及4mL浓硫酸,摇匀,加入沸石。
②装上分水器、电动搅拌器和温度计,加热至分水器下层液体接近支管时将下层液体放入量筒中。继续蒸馏,蒸出过量的乙醇,至瓶内有白烟(约3h),停止加热。
③将反应液倒入盛有80mL冷水的烧杯中,在搅拌下分批加入碳酸钠粉末至溶液无二氧化碳逸出,用pH试纸检验至呈中性。
④用分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层。用无水CaC12干燥,粗产物进行蒸馏,低温蒸出乙醚。当温度超过140℃时,直接接收210-213℃的馏分,最终通过蒸馏得到纯净苯甲酸乙酯12.8mL。
可能用到的有关数据如下:
相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
苯甲酸 | 122 | 1.27 | 249 | 微溶于水,易溶于乙醇、乙醚 |
苯甲酸乙酯 | 150 | 1.05 | 211-213 | 微溶于热水,溶于乙醇、乙醚 |
乙醇 | 46 | 0.79 | 78.5 | 易溶于水 |
乙醚 | 74 | 0.73 | 34.5 | 微溶于水 |
回答以下问题:
(1)反应装置中分水器上方的仪器名称是______,其作用是____
(2)步骤①中加浓硫酸的作用是_________,加沸石的目的是______。
(3)步骤②中使用分水器除水的目的是_________。
(4)步骤③中加入碳酸钠的目的是________ 。
(5)步骤④中有机层从分液漏斗的____(选填“上口倒出”或“下口放出”)。
(6)本实验所得到的苯甲酸乙酯产率是________%。