题目内容
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。目前我国已经在技术上取得突破——从硫酸渣中分离出各种成分并加以利用。其流程和相关数据如下:

查资料得知:
请回答下列问题:
(1)写出固体A的化学式为 。
(2)若要测定溶液的pH是否达到3.7,下列实验用品中可选用的是 。
A.石蕊试液 B.广泛pH试纸 C.精密pH试纸 D.pH计
(3)完成下列离子反应方程式
①溶液D生成固体E ; ②溶液F生成固体G 。
(4)要将固体C、固体E和固体G都转化为相应的稳定氧化物,需进行的实验操作为 。
(5)若不考虑溶液体积的变化,请计算溶液H中c(Mg2+)= 。

查资料得知:
| 物质名称 | 溶度积(Ksp) | pH值 | |
| 开始沉淀 | 完全沉淀 | ||
| Mg(OH)2 | 5.6×10-12 | 9.3 | 10.8 |
| Fe(OH)3 | 2.8×10-16 | 2.7 | 3.7 |
| Al(OH)3 | 1.3×10-33 | 3.7 | 4.7 |
请回答下列问题:
(1)写出固体A的化学式为 。
(2)若要测定溶液的pH是否达到3.7,下列实验用品中可选用的是 。
A.石蕊试液 B.广泛pH试纸 C.精密pH试纸 D.pH计
(3)完成下列离子反应方程式
①溶液D生成固体E ; ②溶液F生成固体G 。
(4)要将固体C、固体E和固体G都转化为相应的稳定氧化物,需进行的实验操作为 。
(5)若不考虑溶液体积的变化,请计算溶液H中c(Mg2+)= 。
(1)SiO2(2分)
(2)CD(2分)
(3)Mg2++2OH―=Mg(OH)2↓(2分); AlO2―+CO2+2H2O=Al(OH)3↓+HCO3―(2分)
(4)加热或高温或灼烧(2分)
(5)5.6×10―10mol/L(2分,无单位扣1分)
(2)CD(2分)
(3)Mg2++2OH―=Mg(OH)2↓(2分); AlO2―+CO2+2H2O=Al(OH)3↓+HCO3―(2分)
(4)加热或高温或灼烧(2分)
(5)5.6×10―10mol/L(2分,无单位扣1分)
试题分析:(1)第一步中加过量盐酸,Fe2O3、Al2O3、MgO与盐酸反应溶解,SiO2不溶过滤可得;(2)A、只能判断溶液的酸碱性,错误;B、广泛pH试纸 只能精确到整数,错误;精密pH试纸 和pH计读数能精确的小数点后一位或更多;(4)流程中得到的固体为氢氧化物,加热灼烧可得氧化物;
(5)溶液H为调节pH=13后得到的溶液,c(OH-)=0.1 mol/L
c(Mg2+)= Ksp÷c2(OH-)= 5.6×10-12÷0.12=5.6×10―10mol/L

练习册系列答案
相关题目
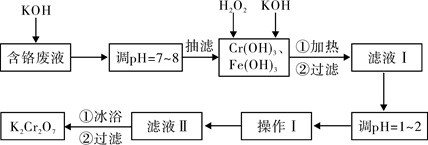



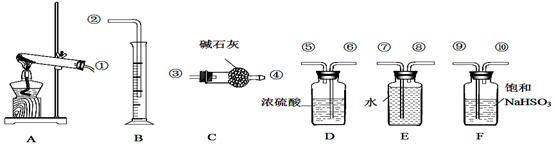
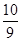 ,其平衡常数表达式为 最终所得气体的平均相对分子质量为__________(保留一位小数)
,其平衡常数表达式为 最终所得气体的平均相对分子质量为__________(保留一位小数)


