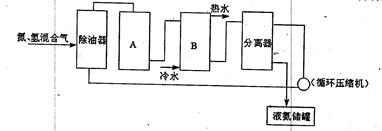
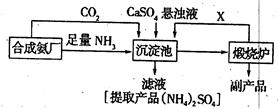
��Ŀ����
�о�����ͭ���ж��ص�ɱ�����ܣ��ܽϺõ����Ʋ�������������ҵ��ͭұ�����¿ɷ�Ϊ��
�ٸ������������ʯ���и�ѡ��
�ڱ��գ���Ҫ��ӦΪ��2CuFeS2+4O2��Cu2S+3SO2+2FeO(¯��)��
���ƴ�ͭ����1200����Ҫ�ķ�ӦΪ��2Cu2S+3O2��2Cu2O+2SO2��2Cu2O+Cu2S��6Cu+SO2����
�ܵ�⾫�����������õ���ͭ��
����˵������ȷ����
�ٸ������������ʯ���и�ѡ��
�ڱ��գ���Ҫ��ӦΪ��2CuFeS2+4O2��Cu2S+3SO2+2FeO(¯��)��
���ƴ�ͭ����1200����Ҫ�ķ�ӦΪ��2Cu2S+3O2��2Cu2O+2SO2��2Cu2O+Cu2S��6Cu+SO2����
�ܵ�⾫�����������õ���ͭ��
����˵������ȷ����
| A���������������е�β������ͨ�백ˮ�У��������� |
| B����⾫��ʱ����ͭӦ�����Դ���������� |
| C����Ӧ2Cu2O+Cu2S��6Cu+SO2���е�Cu2���������� |
| D��ÿ����6mol Cu��������������11mol O2 |
D
������A��������Ӧ��β����Ҫ�Ƕ����������壬ͨ�백ˮ������������泥��������������ʣ�
B����ͭ�ľ���ԭ����ϵ��ؽ��з�����
C�����ݻ��ϼ��жϣ���Ӧ��Cu2O��CuԪ�صĻ��ϼ۽��ͣ�����ԭ��Ϊ��������
D������ÿ����6molCu��Ҫ6molCuFeS2���жϣ�
�⣺A��������β������ͨ�백ˮ������������泥�������������泥���A��ȷ��
B������ͭʱ����ͭ���Դ���������������ص���������B��ȷ��
C����Ӧ��Cu2O��CuԪ�صĻ��ϼ۽��ͣ�����ԭ��Ϊ����������C��ȷ��
D��ÿ����6molCu��Ҫ3molCuFeS2���������з���ʽ��֪������Ҫ���������ʵ���Ϊ��12mol+3mol=15mol����D����
��ѡD��

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
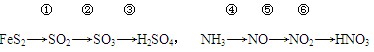
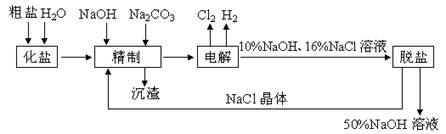
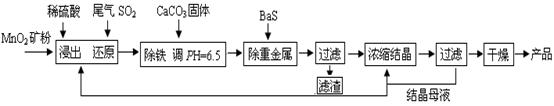
 �IJ�����Mn3O4�������ˮ���ڸ������������̾���ֽⷴӦ�Ļ�ѧ����ʽ�� ��
�IJ�����Mn3O4�������ˮ���ڸ������������̾���ֽⷴӦ�Ļ�ѧ����ʽ�� �� 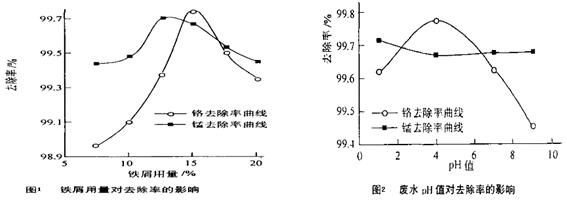
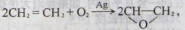 ԭ��������Ϊ100%
ԭ��������Ϊ100%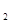 ��H
��H C H
C H
 N2(g)+3H2(g)
N2(g)+3H2(g)  2NH3(g)����H= ��92.4kJ/mol
2NH3(g)����H= ��92.4kJ/mol