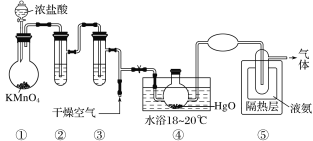
题目内容
【题目】已知X、Y、Z三种元素均为短周期元素,原子序数依次递增,Q、W为前30号元素。5种元素的部分特点:
元素 | 特点 |
X | 其气态氢化物呈三角锥形,水溶液显碱性 |
Y | 基态原子核外有三个能级,其中最外层电子数等于次外层电子数的3倍 |
Z | 元素原子的外围电子层排布式为nsn-1npn-1 |
Q | 被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
W | 原子M能级层为全充满状态且核外的未成对电子只有一个 |
(1)XF3分子中X的杂化类型为______,该分子的空间构型为_______.
(2)基态Q原子的电子排布式为_____________________,第一电离能:X______Y(填“>” “<”或“=”) .
(3)X、Y、Z电负性由大到小的顺序为____________(用元素符号表示).
(4)Na在Y2中燃烧产物的电子式为________________.
(5)Z和X形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于_______晶体.
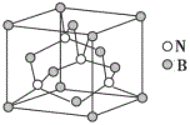
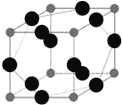
(6)W元素与X元素形成某种化合物的晶胞结构如图所示(黑球代表W原子),若该晶体的密度为ρ g·cm-3,则该晶胞的体积是__________cm3.
【答案】sp3 三角锥形 1s22s22p63s23p63d24s2 > O>N>Si ![]() 原子 206/(NA.ρ)
原子 206/(NA.ρ)
【解析】
X、Y、Z三种元素均为短周期元素,原子序数依次递增,Q、W为前30号元素,由X的气态氢化物呈三角锥形,水溶液显碱性,可知X为N元素;Y的基态原子核外有三个能级,其中最外层电子数等于次外层电子数的3倍,最外层电子数为6,可知Y为O元素;Z的外围电子层排布式为nsn-1npn-1,n-1=2,可知n=3,即外围电子层排布式为3s23p2,Z为Si元素;Q被誉为“太空金属”也有“生物金属”之称,其基态原子次外层有2个未成对电子,Q为Ti元素;W的原子M能级层为全充满状态且核外的未成对电子只有一个,电子排布为1s22s22p63s23p63d104s1,W为Cu元素,据此分析解答。
由上述分析可知,X为N元素、Y为O元素、Z为Si元素、Q为Ti元素、W为Cu元素。
(1)XF3分子中N原子上有1对孤对电子,形成3个N-F键,则X的杂化类型为sp3;空间构型为三角锥形,故答案为:sp3;三角锥形;
(2)Q为Ti元素,原子序数为22,基态Q原子的电子排布式为1s22s22p63s23p63d24s2;N的2p电子半满为稳定结构,则第一电离能X>Y,故答案为:1s22s22p63s23p63d24s2;>;
(3)非金属性越强,电负性越大,则X、Y、Z电负性由大到小的顺序为O>N>Si,故答案为:O>N>Si;
(4)Na在Y2中燃烧的产物为过氧化钠,属于离子化合物,含有离子键和非极性键,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)Z和X形成的化合物常用作高温耐火材料,化学性质稳定,可知熔点高,该化合物形成的晶体为原子晶体,故答案为:原子;
(6)黑球代表W原子,位于棱上,个数为12×![]() =3,N位于顶点,个数为8×
=3,N位于顶点,个数为8×![]() =1,化学式为Cu3N,该晶体的密度为ρ gcm-3,则该晶胞的体积是
=1,化学式为Cu3N,该晶体的密度为ρ gcm-3,则该晶胞的体积是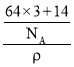 cm3=
cm3=![]() cm3,故答案为:
cm3,故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案