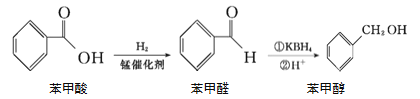
题目内容
【题目】主族元素镓(Ga)的原子结构示意图是  ,下列关系不正确的是( )
,下列关系不正确的是( )
A.原子半径:K>Ga>Al
B.碱性:KOH>Ga(OH)3>Al(OH) 3
C.离子的氧化性:K+>Ga3+>Al3+
D.与水反应的剧烈程度:K>Ga>Al
【答案】C
【解析】解:A.K、Ga位于同一周期,从左到右原子半径逐渐减小,则K>Ga,Ga、Al位于同一主族,从上到下原子半径逐渐增大,则Ga>Al,故A正确; B.K、Ga位于同一周期,从左到右金属性逐渐减弱,则K>Ga,Ga、Al位于同一主族,从上到下金属性逐渐增大,则Ga>Al,则金属性K>Ga>Al,原子的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性:KOH>Ga(OH)3>Al(OH) 3 , 故B正确;
C.金属性K>Ga>Al,元素的金属性越强,对应的阳离子的氧化性越弱,故C错误;
D.金属性K>Ga>Al,金属性越强,对应的单质与水反应越剧烈,故D正确.
故选C.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目