��Ŀ����
����Ŀ����ȥ�����еĶ�������Ͱ�����������Ի�����������Ҫ���塣
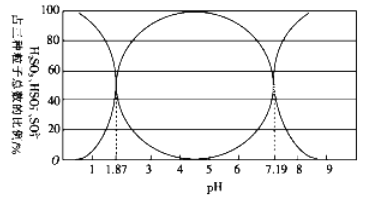
��1����������������ˮ������ˮ��������Һ��H2SO3��HSO3-��SO32- ռ�������������ı�����pH�ı仯����ͼ��ʾ����ͼ��֪H2SO3 �ĵ���ƽ�ⳣ��Ka1=____________��
��2����������[CO��NH2��2]ˮ�����Һ�������պ�SO2 �Ŀ�������֪����ˮ����ȣ�������ˮ�ⷴӦ������ˮ��ķ�Ӧ����ʽ����:CO��NH2��2+H2O=H2NCOONH4���������������
�ٰ�������炙�������е�SO2 ��O2 ��Ӧ������NH4��2SO4,�÷�Ӧ�Ļ�ѧ����ʽΪ__________��
��һ��������,��������Һ���պ�SO2 �Ŀ��������SO2 ������������Һ���¶ȱ仯��ͼ����ʾ���¶ȸ���60 ��ʱ��SO2 �������������ߵ�ԭ����_____________��
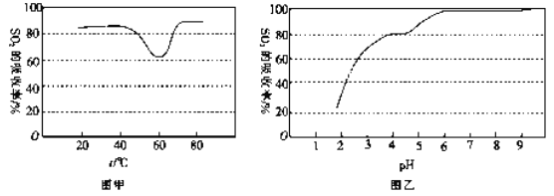
��������Һ����SO2 ������������Һ��pH�仯��ͼ����ʾ��������Һ���պ�SO2�Ŀ�������Һ��pH�ή�ͣ�Ϊ���SO2 �������ʺͳ�ֻ��ղ���������Һ�м���_____������Һ��������������pH Ϊ_______��
��3��һ�ֵ绯ѧ��������ԭ����ͼ��ʾ��
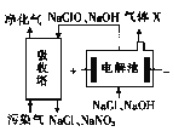
�ٵ��������������ĵ缫��ӦΪ_____________��
����ͬ������ͨ�����Ⱦ�������ɵ�X �������Ϊ40 :3,��Ⱦ����NO ��NO2 ռ�������10%����NaClO��ȫ��Ӧ����Ⱦ����NO��NO2 ����ȫ�������������岻���뷴Ӧ����NO��NO2 �������Ϊ________��
���𰸡� 10-1.87 2H2NCOONH4+2SO2+O2+2H2O=2��NH4��2 SO4+2CO2�� �¶����ߣ�����ˮ�����ɰ�������笠��� ��ˮ 6 2H2O +2e- =H2��+2OH- 1:3
��������(1)����ͼ����pH=1.87�ǣ�c(HSO3-)= c(H2SO3)��H 2SO3�ĵ���ƽ�ⳣ��Ka1=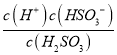 = c(H+)=10-1.87���ʴ�Ϊ��10-1.87��
= c(H+)=10-1.87���ʴ�Ϊ��10-1.87��
(2)�ٰ��������(H2NCOONH4)��������е�SO2��O2��Ӧ����(NH4)2SO4��H2NCOONH4������Ϊ������̼����Ӧ�Ļ�ѧ����ʽΪ2H2NCOONH4+2SO2+O2+2H2O=2(NH4)2 SO4+2CO2�����ʴ�Ϊ��2H2NCOONH4+2SO2+O2+2H2O=2(NH4)2 SO4+2CO2����
������ˮ����ȣ�������ˮ�ⷴӦ������ˮ��ķ�Ӧ����ʽ����:CO(NH2)2+H2O=H2NCOONH4(���������)���¶����ߣ�����ˮ�����ɰ�������識ӿ죬ʹ��SO2�����������ߣ��ʴ�Ϊ���¶����ߣ�����ˮ�����ɰ�������笠�����
��������Һ����SO2������������Һ��pH�仯��ͼ����ʾ��������Һ���պ�SO2�Ŀ�������Һ��pH�ή�ͣ�����ͼ����Һ��pH��6ʹ��SO2�������ʽϸߣ������Ҫ������6���ң���Ҫ����������ʵ�����Һ��pH��Ϊ�˲����������ʣ�����ѡ�ð�ˮ���ڣ��ʴ�Ϊ����ˮ��6��
(3)�ٸ���ͼʾ������Ȼ��ƺ��������ƵĻ����Һ����������Һ�е������ӷŵ����ɴ���������ӣ���������Һ�е�������(ˮ�������ɵ�)�ŵ�������������������ĵ缫��ӦΪ2H2O +2e- =H2��+2OH-���ʴ�Ϊ��2H2O +2e- =H2��+2OH-��
�ڵ����ܷ�Ӧ����ʽΪCl-+ H2O ![]() ClO-+ H2������ͬ������ͨ�����Ⱦ�������ɵ�X�������Ϊ40:3���������ɵ�����Ϊ3mol����ͨ�����Ⱦ��Ϊ40mol�����к���NO��NO2�����ʵ���֮��Ϊ4mol������3mol������ת�Ƶĵ���Ϊ6mol�����ݵ�ʧ�����غ㣬NO��NO2ת�Ƶĵ���Ҳ��6mol����NO��NO2�����ʵ����ֱ�Ϊx��y����x+y=4mol��3x+y=6mol�����x=1mol��y=3mol����NO��NO2�������=NO��NO2�������ʵ�����=1:3���ʴ�Ϊ��1:3��
ClO-+ H2������ͬ������ͨ�����Ⱦ�������ɵ�X�������Ϊ40:3���������ɵ�����Ϊ3mol����ͨ�����Ⱦ��Ϊ40mol�����к���NO��NO2�����ʵ���֮��Ϊ4mol������3mol������ת�Ƶĵ���Ϊ6mol�����ݵ�ʧ�����غ㣬NO��NO2ת�Ƶĵ���Ҳ��6mol����NO��NO2�����ʵ����ֱ�Ϊx��y����x+y=4mol��3x+y=6mol�����x=1mol��y=3mol����NO��NO2�������=NO��NO2�������ʵ�����=1:3���ʴ�Ϊ��1:3��

