题目内容
【题目】现有A、B、C、 D、E、F 原子序数依次增大的六种元素,它们位于元素周期表的前四周期。A元素能级数与核外电子数相等;B 元素含有3个能级,且每个能级所含的电子数相同;D 的原子核外有8 个运动状态不同的电子,E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E 元素的基态原子有4 个未成对电子。请回答下列问题:
(1)请写出D 基态的价层电子排布图_______________。
(2)下列说法错误的是______________。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点: SiO2>CO2
B.电负性顺序: C
C.N 2 与CO 为等电子体,结构相以,化学性质相似
D.稳定性:H2O>H2S,原因是水分子间存在氢键
(3)某化合物与F(I)(I 表示化合价为+1)结合形成下图所示的离子,该离子中碳原子的杂化方式是______。

(4)己知(BC)2 是直线性分子,并有对称性,且分子中每个原子最外层都达到8电子稳定结构,则(BC)2中σ键和π键的个数比为_________________。
(5) C元素最高价含氧酸与硫酸酸性强度相近,原因是______________。
(6) B单质的一种的晶体结构如图所示,则一个晶胞中所含B 原子数为__________;其中原子坐标参数a 为0,0,0), b 为(1/2,1/2,0),则c点原子的坐标参数为______________。

(7)D与F 形成离子个数比为1:1的化合物,晶胞与NaCl类似,D 离子的配位数是______;设D离子的半径为apm,F离子的半径为bpm,求该晶胞的空间利用率为__________(列出计算式即可)。
【答案】 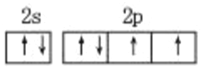 AD sp2、sp3 3:4 HNO3的非羟基氧个数与H2SO4的非羟基氧个数相同,所以酸性强度相近 8 (1,1/2,1/2) 6
AD sp2、sp3 3:4 HNO3的非羟基氧个数与H2SO4的非羟基氧个数相同,所以酸性强度相近 8 (1,1/2,1/2) 6 
【解析】本题主要考查物质结构。根据题意判断A、B、C、D、E、F分别是氢、碳、氮、氧、铁、铜。
(1)D基态的价层电子排布图:![]() 。
。
(2)A.二氧化硅晶体属于原子晶体,二氧化碳晶体属于分子晶体,所以沸点:SiO2>CO2,故A错误;B.非金属性:C<N<O<F,所以电负性顺序:C<N<O<F,故B正确;C.N2与CO为2个原子、10个价电子的等电子体,结构相以,化学性质相似,故C正确;D.稳定性:H2O>H2S,原因是非金属性:O>S,故D错误。故选AD。
(3)该离子中单键碳原子的杂化方式是sp3,苯环碳原子、双键碳原子的杂化方式是sp2。
(4)(BC)2分子的结构式为N≡C—C≡N,则(BC)2中σ键和π键的个数比为3:4。
(5)C元素最高价含氧酸与硫酸酸性强度相近,原因是HNO3的非羟基氧个数与H2SO4的非羟基氧个数相同,所以酸性强度相近。
(6)该晶胞内含有4个B原子,顶点平均含有一个B原子,6个面心平均含有3个B原子,则一个晶胞中共含有8个B原子;其中原子坐标参数a为0,0,0),b为(1/2,1/2,0),则c点原子的坐标参数为(1,1/2,1/2)。
(7)以D离子为中心的八面体顶点是F离子,D离子的配位数是6;晶胞含有4个D离子和4个F离子,晶胞的边长为(2a+2b)pm,该晶胞的空间利用率=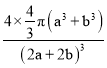 =
=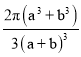 。
。


