题目内容
12.下列实验事实陈述ⅠⅡ正确并且有因果关系的是( )| Ⅰ操作 | Ⅱ结论 | |
| A | 滴加BaC12溶液生成白色沉淀 | 原溶液中有SO42- |
| B | 用洁净铂丝蘸取溶液进行焰色反应:火焰呈黄色 | 原溶液中有Na+无K+ |
| C | 滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝 | 原溶液中无NH4+ |
| D | 滴加氯水和CC14,振荡、静置.下层溶液显紫色 | 原溶液中有I- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.钡离子与碳酸根离子、亚硫酸根离子都能产生白色沉淀,银离子与氯离子能生成氯化银白色沉淀;
B.观察钾元素的焰色反应时要透过蓝色的钴玻璃;
C.四氯化碳的密度大于水且和水不互溶,碘易于四氯化碳而难溶于水;
D.溶液中可能含有氢离子等与氢氧根离子反应.氨气极易溶于水,稀溶液中,铵根离子与氢氧化钠反应,不加热,不能产生氨气.
解答 解:A.滴加BaC12溶液生成白色沉淀,可能含有碳酸根离子、亚硫酸根离子、硫酸根离子或者氯离子中的一种或者几种,Ⅱ结论错误,故A不选;
B.钠离子的焰色反应呈黄色,但是对钾离子检验会造成干扰,钾离子的焰色反应要透过钴玻璃来观察,Ⅱ结论错误,故B不选;
C.溶液中可能含有氢离子等,优先与氢氧根离子反应,铵根离子不能反应.氨气极易溶于水,稀溶液中,铵根离子与氢氧化钠反应,不加热,不能产生氨气,故不能说明原溶液中是否含有NH4+,故C不选;
D.四氯化碳的密度大于水且和水不互溶,碘在四氯化碳中的溶解度大于在水中的溶解度,所以向碘水中加入四氯化碳时能发生萃取,导致下层液体呈紫色上层液体无色,故D选;
故选:D.
点评 本题考查了实验方案设计,明确实验原理是解本题关键,注意萃取原理、焰色反应实验注意事项、离子检验方法,题目难度不大,注意相关知识的积累.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
2.下列事实能证明某化合物中存在离子键的是( )
| A. | 该物质在液态时能导电 | B. | 该物质在水溶液中能导电 | ||
| C. | 该物质能溶于水 | D. | 该物质具有较高的熔、沸点 |
3.下列说法正确的是( )
| A. | 能够使品红试液褪色的气体一定是SO2 | |
| B. | 常温下,铁、铝不与浓硫酸反应,因此可以用铁、铝容器贮存运输浓硫酸 | |
| C. | 硝酸铵受热易分解爆炸,实验室常加热氯化铵与氢氧化钙的混合物制备氨气 | |
| D. | 一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 |
20.同一周期的X、Y、Z三种元素,其最高价氧化物对应水化物的酸性强弱顺序为:HZO4>H2YO4>H3XO4,则下列判断正确的是( )
| A. | 单质的氧化性为:Z>Y>X | B. | 非金属性:X>Y>Z | ||
| C. | 气态氢化物的稳定性:XH3>H2Y>HZ | D. | 原子半径:Z>Y>X |
7.某课外小组同学通过实验发现钾和钠的化学性质相似.下列解释最合理的是( )
| A. | 都属于金属元素 | B. | 原子半径相差不大 | ||
| C. | 原子的电子层数相接近 | D. | 原子的最外层电子数相同 |
17.醛类物质在生活中比较常见,如“福尔马林”、“变质植物油的哈喇味”等等.某饱和一元醛发生银镜反应时可以析出21.6g银,等量的醛完全燃烧可以产生8.96LCO2(标准状况),则该醛为( )
| A. | 乙醛 | B. | 甲醛 | C. | 丙醛 | D. | 丁醛 |
2.设阿伏加德罗常数的值为NA,下列说法中正确的是( )
| A. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| B. | 0.1mol甲基中含有的电子数为NA | |
| C. | 2.8 g乙烯和聚乙烯的混合物中所含碳原子数为0.2NA | |
| D. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA |
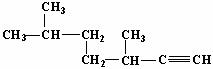 的名称为3,6-二甲基-1-庚炔;
的名称为3,6-二甲基-1-庚炔;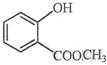 中含氧官能团的名称为羟基、酯基.
中含氧官能团的名称为羟基、酯基.