题目内容
将5.1g镁铝合金投入到500mL2mol·L-l的盐酸中,金属完全溶解后,再加入4mol·L-1的NaOH溶液,若要使得到的沉淀量为最大值,应加入NaOH溶液的体积为( )
| A.560mL | B.500mL | C.425mL | D.250mL |
D
由
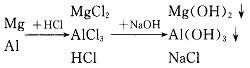
由上述分析可知:沉淀量最多时应是Mg2+、Al3+全部以沉淀形式存在的情形。显然,此时溶液中只存在NaCl,而不可能有HCl或NaOH,所以当n(Na+)=n(Cl-),也就是n(NaOH)=n(HCl)时,沉淀量最多。由此可求NaOH溶液的体积为250mL。
11.(1)[Al(OH)4]-;(2)Zn+2NaOH+2H2O=Na2[Zn(OH)4]+H2↑;(3)①③④;(4)Al3++3NH3·H2O=2Al(OH)3↓+3NH4+;可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中生成[Zn(NH3)4]2+,氨水的用量不易控制。
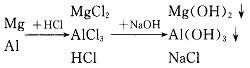
由上述分析可知:沉淀量最多时应是Mg2+、Al3+全部以沉淀形式存在的情形。显然,此时溶液中只存在NaCl,而不可能有HCl或NaOH,所以当n(Na+)=n(Cl-),也就是n(NaOH)=n(HCl)时,沉淀量最多。由此可求NaOH溶液的体积为250mL。
11.(1)[Al(OH)4]-;(2)Zn+2NaOH+2H2O=Na2[Zn(OH)4]+H2↑;(3)①③④;(4)Al3++3NH3·H2O=2Al(OH)3↓+3NH4+;可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中生成[Zn(NH3)4]2+,氨水的用量不易控制。

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案
相关题目
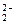 的电子式为[∶C┋┋C∶]2-
的电子式为[∶C┋┋C∶]2-