题目内容
 氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.(1)一定温度下,在1L容积恒定的密闭容器中充入2mol N2和8mol H2并发生反应.10min达平衡,测得氨气的浓度为0.4mol/L,此时氮气的转化率为
10%
10%
.若想提高氨气的产率,根据化学平衡移动原理,提出合理的建议(写出一条即可)增大反应物浓度(或降低温度,或增大压强,或及时转移走生成的氨)
增大反应物浓度(或降低温度,或增大压强,或及时转移走生成的氨)
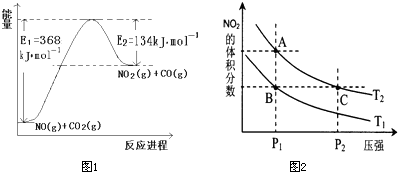
.(2)如图是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
.(3)在容积恒定的密闭容器中,进行如下反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
| T/K | 398 | 498 |
| 平衡常数K | K1 | K2 |
| c2(NH3) |
| c(N2)×c3(H2) |
| c2(NH3) |
| c(N2)×c3(H2) |
②试判断K1
>
>
K2(填写“>”“=”或“<”);③NH3(g)燃烧的方程式为4NH3(g)+7O2(g)═4NO2(g)+6H2O(l),已知:
2H2(g)+O2(g)═2H2O(l)△H=-483.6kJ/mol
N2(g)+2O2(g)═2NO2(g)△H=+67.8kJ/mol
N2(g)+3H2(g)═2NH3(g)△H=-92.0kJ/mol
请计算NH3(g)的燃烧热
282.8kJ/mol
282.8kJ/mol
.分析:(1)根据氨气的浓度计算氮气的浓度变化量,氮气的转化率=
×100%;
提高氨气的产率,可以改变条件使平衡向正反应方向移动;
(2)根据能量变化图,反应热等于正反应的活化能减去逆反应的活化能;
(1)①平衡常数等于生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积,据此书写;
②该反应正反应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小;
③根据盖斯定律构造目标热化学方程式,据此计算燃烧热,注意氨气的系数为1,生成的水为液态.
| 氮气浓度变化量 |
| 氮气的起始浓度 |
提高氨气的产率,可以改变条件使平衡向正反应方向移动;
(2)根据能量变化图,反应热等于正反应的活化能减去逆反应的活化能;
(1)①平衡常数等于生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积,据此书写;
②该反应正反应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小;
③根据盖斯定律构造目标热化学方程式,据此计算燃烧热,注意氨气的系数为1,生成的水为液态.
解答:解:(1)10min达平衡,测得氨气的浓度为0.4mol/L,则氮气的浓度变化量为0.4mol/L×
=0.2mol/L,故氮气的转化率=
×100%=10%;
增大反应物浓度,降低温度,增大压强,或及时转移走生成的氨,都可以使平衡向正反应方向移动,氨气的产率提高,
故答案为:10%;增大反应物浓度(或降低温度,或增大压强,或及时转移走生成的氨);
(2)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1;
(3)①N2(g)+3H2(g)?2NH3(g)的平衡常数表达式k=
,
故答案为:
;
②N2(g)+3H2(g)?2NH3(g)△H<0,正反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,所以K1>K2,
故答案为:>;
③NH3(g)燃烧的方程式为4NH3(g)+7O2(g)═4NO2(g)+6H2O(l),已知:
Ⅰ、2H2(g)+O2(g)═2H2O(l)△H=-483.6kJ/mol
Ⅱ、N2(g)+2O2(g)═2NO2(g)△H=+67.8kJ/mol
Ⅲ、N2(g)+3H2(g)═2NH3(g)△H=-92.0kJ/mol
根据盖斯定律,Ⅱ×2-Ⅲ×2+Ⅰ×3得:4NH3(g)+7O2(g)═4NO2(g)+6H2O(l),△H=2×67.8kJ/mol
-2×(-92.0kJ/mol)+3×(-483.6kJ/mol)=-1131.2kJ/mol,
故氨气的燃烧热为
=282.8kJ/mol,
故答案为:282.8kJ/mol.
| 1 |
| 2 |
| 0.2mol/L |
| 2mol/L |
增大反应物浓度,降低温度,增大压强,或及时转移走生成的氨,都可以使平衡向正反应方向移动,氨气的产率提高,
故答案为:10%;增大反应物浓度(或降低温度,或增大压强,或及时转移走生成的氨);
(2)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1;
(3)①N2(g)+3H2(g)?2NH3(g)的平衡常数表达式k=
| c2(NH3) |
| c(N2)×c3(H2) |
故答案为:
| c2(NH3) |
| c(N2)×c3(H2) |
②N2(g)+3H2(g)?2NH3(g)△H<0,正反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,所以K1>K2,
故答案为:>;
③NH3(g)燃烧的方程式为4NH3(g)+7O2(g)═4NO2(g)+6H2O(l),已知:
Ⅰ、2H2(g)+O2(g)═2H2O(l)△H=-483.6kJ/mol
Ⅱ、N2(g)+2O2(g)═2NO2(g)△H=+67.8kJ/mol
Ⅲ、N2(g)+3H2(g)═2NH3(g)△H=-92.0kJ/mol
根据盖斯定律,Ⅱ×2-Ⅲ×2+Ⅰ×3得:4NH3(g)+7O2(g)═4NO2(g)+6H2O(l),△H=2×67.8kJ/mol
-2×(-92.0kJ/mol)+3×(-483.6kJ/mol)=-1131.2kJ/mol,
故氨气的燃烧热为
| 1131.2kJ/mol |
| 4 |
故答案为:282.8kJ/mol.
点评:本题主要考查了化学平衡的有关计算、化学平衡影响因素、化学平衡常数,反应热的计算等,难度中等,(3)中燃烧热的计算为易错点,学生容易根据盖斯定律计算反应热,忽略燃烧热.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.