��Ŀ����
 ���ǵ����Ϻ����ḻ��Ԫ�أ������仯������о���������������������Ҫ���壮
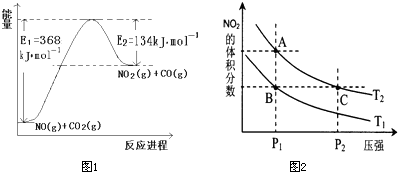
���ǵ����Ϻ����ḻ��Ԫ�أ������仯������о���������������������Ҫ���壮��1����ͼ��1mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ��д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ
NO2��g��+CO��g��=CO2��g��+NO��g����H=-234kJ?mol-1
NO2��g��+CO��g��=CO2��g��+NO��g����H=-234kJ?mol-1
�����ڷ�Ӧ��ϵ�м������ʹ��Ӧ����������E1�ı仯����С
��С
���÷�Ӧ�ķ�Ӧ�ȡ�H����
����
���������С�����䡱������2����֪��N2��g��+O2��g��=2NO��g����H=+180kJ?mol-1
2NO��g��+2CO��g��=N2��g��+2CO2��g����H=-746kJ?mol-1
��ӦCO��g��+
| 1 |
| 2 |
-283
-283
kJ?mol-1��3���������¡��˹��̵������о��������ڳ��¡���ѹ�����������£�N2�ڴ�������������Fe2O3��TiO2��������ˮ�������з�Ӧ��N2��g��+3H2O��l��=2NH3��g��+
| 3 |
| 2 |
Ϊ��һ���о�NH3���������¶ȵĹ�ϵ����ó�ѹ�´ﵽƽ��ʱ����ʵ���������±���
| T/K | 303 | 313 | 323 |
| NH3������/��10-6mol�� | 4.8 | 5.9 | 6.0 |
��
��
0����s��
��
0�������������������=������4����һ�̶��ݻ�Ϊ2L���ܱ������ڼ���2mol NH3��3mol O2��������Ӧ4NH3��g��+5O2��g��?4NO��g��+6H2O��g����2min��ﵽƽ�⣬����1.2mol NO����ǰ2���ӵ�ƽ����Ӧ����v��NH3��Ϊ
0.3mol/��L?min����
0.3mol/��L?min����
��ƽ��ʱO2��ת����Ϊ50%
50%
���÷�Ӧƽ�ⳣ���ı���ʽK=| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
��5��ij�¶��£������Ϊ0.25L�����������ܱ������з������з�Ӧ��N2��g��+3H2��g��
| ���� |
| ���¸�ѹ |
| ���� ��� |
��ʼʱ�����ʵ����ʵ���/mol | ��Ӧ��ƽ��ʱ���ʱ�/kJ?mol-1 | ||
| N2 | H2 | NH3 | ||
| A | 1 | 3 | 0 | ��H1=-23.1 |
| B | 0.9 | 2.7 | 0.2 | ��H2 |
13.86
13.86
����������1�����������仯ͼ����Ӧ�ȵ�������Ӧ�Ļ�ܼ�ȥ�淴Ӧ�Ļ�ܣ����ݴ����ܽ��ͷ�Ӧ�Ļ�ܣ�����Ӱ�췴Ӧ�ȵĴ�С��
��2���ݸ�˹���ɣ����ú�2����ѧ����ʽ�Ϳ��������Ӧ���ʱ䣻
��3�������¶ȶԻ�ѧƽ���ƶ������Ӱ�����жϷ�Ӧ���������������������Ӧ��������ʵ�����С�����Ҷȼ�С��������s��
��4���ȸ��ݻ�ѧ��Ӧ����V=
=
��NO�����ʣ�Ȼ������ϵ��֮�ȵ��ڻ�ѧ��Ӧ����֮������NH3�����ʣ����ݱ仯�ĸ����ʵ����ʵ���֮�ȵ��ڻ�ѧ������֮�������Ӧ�����������ʵ�����Ȼ������������������ʵ�����Ȼ�����ת���ʵ����ѷ�Ӧ�����ʵ�������ԭ�������ʵ��������ݻ�ѧƽ�ⳣ������ƽ��ʱ��������Ũ�ȵĻ�ѧ���������ݵij˻����Ը���Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻����õı�ֵ��
��5������A������Ӧ�ȼ������ɰ��������ʵ��������ݵ�Чƽ���ж�B������Ӧ�ĵ��������ʵ��������������ʵ����������Ĺ�ϵ��⣮
��2���ݸ�˹���ɣ����ú�2����ѧ����ʽ�Ϳ��������Ӧ���ʱ䣻
��3�������¶ȶԻ�ѧƽ���ƶ������Ӱ�����жϷ�Ӧ���������������������Ӧ��������ʵ�����С�����Ҷȼ�С��������s��
��4���ȸ��ݻ�ѧ��Ӧ����V=
| ��C |
| ��t |
| ||
| ��t |
��5������A������Ӧ�ȼ������ɰ��������ʵ��������ݵ�Чƽ���ж�B������Ӧ�ĵ��������ʵ��������������ʵ����������Ĺ�ϵ��⣮
����⣺��1���÷�Ӧ���ʱ��H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol�������Ȼ�ѧ����ʽΪ��NO2��g��+CO��g��=CO2��g��+NO��g����H=-234kJ?mol-1��
�����ܽ��ͷ�Ӧ�Ļ�ܣ�����Ӱ�췴Ӧ�ȵĴ�С�������ڷ�Ӧ��ϵ�м������ʹ��Ӧ����������E1��С���÷�Ӧ�ķ�Ӧ�ȡ�H���䣬
�ʴ�Ϊ��NO2��g��+CO��g��=CO2��g��+NO��g����H=-234kJ?mol-1����С�����䣻
��2��N2��g��+O2��g��=2NO��g����H=+180kJ?mol-1 ��
2NO��g��+2CO��g��=N2��g��+2CO2��g����H=-746kJ?mol-1 ��
���ݸ�˹���ɣ�
���ã�CO��g��+
O2��g��=CO2��g����=-283kJ?mol-1��
�ʴ�Ϊ��-283��
��3���ɱ�֪�¶�Խ�ߣ���������Խ�������¶ȣ�ƽ�����ҽ��У���������Ӧ�����ȷ�Ӧ����H��0��
����Ӧ��������ʵ�����С�����Ҷȼ�С�����ԡ�s��0��
�ʴ�Ϊ����������
��4��NO������V��NO��=
=0.3mol/��L?min����ǰ2���ӵ�ƽ����Ӧ����v��NH3��=V��NO��=0.3mol/��L?min����2min��ﵽƽ�⣬����1.2mol NO����������1.5molO2������������ת����Ϊ��
��100%=50%����Ӧƽ�ⳣ���ı���ʽK=
��
�ʴ�Ϊ��0.3mol/��L?min����50%��
��
��5�������зų�23.1kJ�����������ɰ��������ʵ���Ϊ��
=0.5mol����������ʽ�����㣺
N2��g��+3H2��g��?2NH3��g����H=һ92.4kJ/mol
��ʼ��1mol 3mol 0
ת����0.25mol 0.75mol 0.5mol
ƽ�⣺0.75mol 2.25mol 0.5mol
�ӵ�Чƽ��ĽǶȷ�����0.9molN2��2.7molH2��0.2molNH3�൱��1molN2��3molH2������ͬ�����´�����ͬƽ��״̬������B�����ķ�Ӧ������У��ﵽƽ��ʱ����0.15molN2�����Էų�������Ϊ0.15mol��92.4kJ/mol=13.86
kJ��
�ʴ�Ϊ��13.86��
�����ܽ��ͷ�Ӧ�Ļ�ܣ�����Ӱ�췴Ӧ�ȵĴ�С�������ڷ�Ӧ��ϵ�м������ʹ��Ӧ����������E1��С���÷�Ӧ�ķ�Ӧ�ȡ�H���䣬
�ʴ�Ϊ��NO2��g��+CO��g��=CO2��g��+NO��g����H=-234kJ?mol-1����С�����䣻
��2��N2��g��+O2��g��=2NO��g����H=+180kJ?mol-1 ��
2NO��g��+2CO��g��=N2��g��+2CO2��g����H=-746kJ?mol-1 ��
���ݸ�˹���ɣ�
| ��+�� |
| 2 |
| 1 |
| 2 |
�ʴ�Ϊ��-283��
��3���ɱ�֪�¶�Խ�ߣ���������Խ�������¶ȣ�ƽ�����ҽ��У���������Ӧ�����ȷ�Ӧ����H��0��
����Ӧ��������ʵ�����С�����Ҷȼ�С�����ԡ�s��0��
�ʴ�Ϊ����������
��4��NO������V��NO��=
| ||
| 2min |
| 1.5mol |
| 3mol |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
�ʴ�Ϊ��0.3mol/��L?min����50%��
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
��5�������зų�23.1kJ�����������ɰ��������ʵ���Ϊ��
| 2mol��23.1kJ |
| 92.4kJ |
N2��g��+3H2��g��?2NH3��g����H=һ92.4kJ/mol
��ʼ��1mol 3mol 0
ת����0.25mol 0.75mol 0.5mol
ƽ�⣺0.75mol 2.25mol 0.5mol
�ӵ�Чƽ��ĽǶȷ�����0.9molN2��2.7molH2��0.2molNH3�൱��1molN2��3molH2������ͬ�����´�����ͬƽ��״̬������B�����ķ�Ӧ������У��ﵽƽ��ʱ����0.15molN2�����Էų�������Ϊ0.15mol��92.4kJ/mol=13.86
kJ��
�ʴ�Ϊ��13.86��
���������⿼�����Ȼ�ѧ����ʽ����ѧƽ�ⳣ������ѧƽ���ƶ�����ѧ��Ӧ���ʵļ���ȣ���Ŀ��Ϊ�ۺϣ��Ѷ��еȣ�ע�����ⷽ�����жϹ��ɵĻ��ۣ�

��ϰ��ϵ�д�
�����Ŀ