题目内容
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
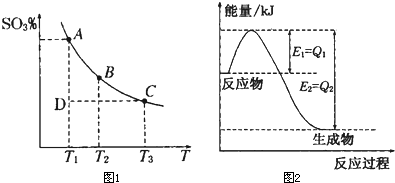
Ⅰ.硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态).

根据图示回答下列问题:
①2SO2(g)+O2(g)?2SO3(g)的△H
②若在恒温、恒容条件下向上述平衡体系中通He,V正
③若在恒温、恒压条件下向上述平衡体系中通入氦气,V正
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①如图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:
②工业合成氨的反应为N2(g)+3H2(g)
2NH3(g).在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是
A、增大压强 B、增大反应物的浓度 C、使用催化剂 D、降低温度
③工业合成氨的反应为N2(g)+3H2(g)
2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g).反应在一定条件下达到平衡时,NH3的体积分数为
.计算:该条件下N2(g)+3H2(g)
2NH3(g)的平衡常数为
④已知化学反应:N2(g)+3H2(g)?2NH3(g);其化学平衡常数K与温度T的关系如下表:
400℃时,在2L的密闭容器中2NH3(g)?N2(g)+3H2(g) 的化学平衡常数K的值为
Ⅰ.硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态).

根据图示回答下列问题:
①2SO2(g)+O2(g)?2SO3(g)的△H
<
<
0.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>
>
K2;若反应进行到状态D时,v正>
>
v逆(填“>”、“<”或“=”).②若在恒温、恒容条件下向上述平衡体系中通He,V正
不变
不变
(填“增大”、“减小”或“不变”);平衡不
不
移动(填“向左”、“向右”或“不”).③若在恒温、恒压条件下向上述平衡体系中通入氦气,V正
减小
减小
,V逆减小
减小
;平衡向左
向左
移动.Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①如图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:
N2(g)+3H2(g)═2NH3(g)△H=-2(b-a)kJ?mol-1
N2(g)+3H2(g)═2NH3(g)△H=-2(b-a)kJ?mol-1
(△H的数值用含字母a、b的代数式表示).②工业合成氨的反应为N2(g)+3H2(g)
| ||
| 高温 |
AB
AB
.A、增大压强 B、增大反应物的浓度 C、使用催化剂 D、降低温度
③工业合成氨的反应为N2(g)+3H2(g)
| ||
| 高温 |
| 4 |
| 7 |
| ||
| 高温 |
200
200
;N2的平衡转化率为66.7%
66.7%
.④已知化学反应:N2(g)+3H2(g)?2NH3(g);其化学平衡常数K与温度T的关系如下表:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
2
2
.当测得NH3和N2、H2的物质的量分别为12mol和8mol、4mol时,则该反应的v正(N2)大于
大于
v逆(N2)(填“大于”、“小于”或“等于”)分析:Ⅰ.①由图可知,温度越高,混合体系中SO3的百分含量越小,说明升高温度平衡向逆反应进行,升高温度向吸热反应方向移动;
②氦气不参与化学反应,体积不变,气体的浓度不变,反应速率不变,以此判断;
③恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低;
Ⅱ.①根据热化学反应方程式的书写规则书写,书写时注意表明物质的状态,反应热=反应物吸收的能量-生成物放出的能量,注意反应热与反应方程式有关;
②平衡常数只与温度有关,催化剂不能改变平衡状态;
③根据反应N2(g)+3H2(g)
2NH3(g)可计算平衡时各物质的浓度,根据平衡常数的表达式计算平衡常数,进而可计算转化率;
④可逆反应的平衡常数互为倒数关系,计算某时刻时各物质的浓度幂与平衡常数比较,可判断反应方向.
②氦气不参与化学反应,体积不变,气体的浓度不变,反应速率不变,以此判断;
③恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低;
Ⅱ.①根据热化学反应方程式的书写规则书写,书写时注意表明物质的状态,反应热=反应物吸收的能量-生成物放出的能量,注意反应热与反应方程式有关;
②平衡常数只与温度有关,催化剂不能改变平衡状态;
③根据反应N2(g)+3H2(g)
| ||
| 高温 |
④可逆反应的平衡常数互为倒数关系,计算某时刻时各物质的浓度幂与平衡常数比较,可判断反应方向.
解答:解:Ⅰ.①该反应是一个气体体积减小的反应,升高温度,平衡向吸热反应方向移动,升高温度时,SO3(g)的含量降低,说明平衡向逆反应方向移动,所以正反应是放热反应,△H<0;升高温度平衡向你反应方向移动,则平衡常数减小,所以K1>K2;反应进行到状态D时,没有达到平衡状态,反应的趋势是向生成SO3的方向进行,即向正反应方向移动,则
v正>v逆,故答案为:<;>;>;
②氦气不参与化学反应,体积不变,气体的浓度不变,反应速率不变,则平衡不移动,故答案为:不变;不;
③恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,正逆反应速率都减小,压强降低平衡向体积增大方向移动,即向左移动,故答案为:减小;减小;向左
Ⅱ.①由图可知,N2和H2反应生成1molNH3放出的热量为(b-a)kJ,该反应的热化学反应方程式为N2(g)+3H2(g)?2NH3(g)△H=-2(b-a)kJ?mol-1,故答案为:N2(g)+3H2(g)═2NH3(g)△H=-2(b-a)kJ?mol-1;
②平衡常数只与温度有关,催化剂不能改变平衡状态,故答案为:AB;
③N2(g)+3H2(g)
2NH3(g)
起始(mol/L):0.3 0.8 0
转化(mol/L):x 3x 2x
平衡(mol/L):0.3-x 0.8-3x 2x
则有
=
,
x=0.2,
该条件下N2(g)+3H2(g)
2NH3(g)的平衡常数为
=200,
N2的平衡转化率为
×100%=66.7%,
故答案为:200;66.7%;
④400℃时,N2(g)+3H2(g)?2NH3(g)的平衡常数为0.5,即
=0.5,则
=2,即2NH3(g)?N2(g)+3H2(g) 的化学平衡常数K的值为2,
400℃时,在2L的密闭容器中当测得NH3和N2、H2的物质的量分别为12mol和8mol、4mol时,
Q=
=
=0.89<2,没有到达平衡,此时反应向正反应方向移动,正反应速率大于逆反应速率,
故答案为:2;大于.
v正>v逆,故答案为:<;>;>;
②氦气不参与化学反应,体积不变,气体的浓度不变,反应速率不变,则平衡不移动,故答案为:不变;不;
③恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,正逆反应速率都减小,压强降低平衡向体积增大方向移动,即向左移动,故答案为:减小;减小;向左
Ⅱ.①由图可知,N2和H2反应生成1molNH3放出的热量为(b-a)kJ,该反应的热化学反应方程式为N2(g)+3H2(g)?2NH3(g)△H=-2(b-a)kJ?mol-1,故答案为:N2(g)+3H2(g)═2NH3(g)△H=-2(b-a)kJ?mol-1;
②平衡常数只与温度有关,催化剂不能改变平衡状态,故答案为:AB;
③N2(g)+3H2(g)
| ||
| 高温 |
起始(mol/L):0.3 0.8 0
转化(mol/L):x 3x 2x
平衡(mol/L):0.3-x 0.8-3x 2x
则有
| 2x |
| 0.3-x+0.8-3x+2x |
| 4 |
| 7 |
x=0.2,
该条件下N2(g)+3H2(g)
| ||
| 高温 |
| 0.42 |
| 0.1×0.23 |
N2的平衡转化率为
| 0.2 |
| 0.3 |
故答案为:200;66.7%;
④400℃时,N2(g)+3H2(g)?2NH3(g)的平衡常数为0.5,即
| c2(NH3) |
| c (N2)?c3(H2) |
| c(N2)?c3(H2) |
| c2(NH3) |
400℃时,在2L的密闭容器中当测得NH3和N2、H2的物质的量分别为12mol和8mol、4mol时,
Q=
| c(N2)?c3(H2) |
| c2(NH3) |
| 4×23 |
| 62 |
故答案为:2;大于.
点评:本题考查了外界条件对化学平衡的影响、反应热的计算等知识点,难度不大,注意化学平衡常数只与温度有关,与其他物理量无关,把握利用三段式计算.

练习册系列答案
相关题目

 运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.