题目内容
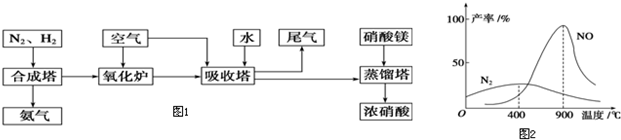
(2012?延边州模拟)氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用.
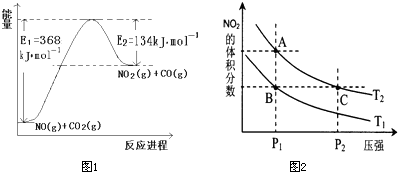
(1)根据如图1所示能量变化示意图,请写出NO和CO2反应的热化学方程式
(2)在固定体积的密闭容器中,进行如下化学反应:
2NH3(g)?N2(g)+3H2(g)△H>0,
其平衡常数K与温度T的关系如下表:
①试判断K1
②该反应的熵变△S
③下列各项能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的物质的量之比为1:3:2
b.2v(NH3)正=3v(H2)逆
c.容器内混合气体平均相对分子质量保持不变
d.混合气体的密度保持不变
④一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应.若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的
,则N2的转化率α(N2)=
(3)①有相同温度下相同浓度的三种盐溶液:A.NH4HCO3;B.NH4 HSO4;C.NH4Cl,按pH由大到小的顺序排列
②在常温常压下pH均等于5的NH4Cl和HCl溶液,两种溶液中由水电离出来的c(H+)之比为
(4)对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示,下列说法正确的是
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法.

(1)根据如图1所示能量变化示意图,请写出NO和CO2反应的热化学方程式
CO2(g)+NO(g)=NO2(g)+CO(g)△H=+234kJ?mol-1
CO2(g)+NO(g)=NO2(g)+CO(g)△H=+234kJ?mol-1
.(2)在固定体积的密闭容器中,进行如下化学反应:
2NH3(g)?N2(g)+3H2(g)△H>0,
其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 2.44ⅹ10-6 | K1 | K2 |
<
<
K2(填写“>”,“<”或“=”);②该反应的熵变△S
>
>
0 (填“>”,“<”或“=”);③下列各项能说明该反应已达到平衡状态的是
c
c
(填字母);a.容器内N2、H2、NH3的物质的量之比为1:3:2
b.2v(NH3)正=3v(H2)逆
c.容器内混合气体平均相对分子质量保持不变
d.混合气体的密度保持不变
④一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应.若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的
| 9 |
| 10 |
20%
20%
.(3)①有相同温度下相同浓度的三种盐溶液:A.NH4HCO3;B.NH4 HSO4;C.NH4Cl,按pH由大到小的顺序排列
ACB
ACB
(填字母);②在常温常压下pH均等于5的NH4Cl和HCl溶液,两种溶液中由水电离出来的c(H+)之比为
104:1
104:1
.(4)对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示,下列说法正确的是
cd
cd
.a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法.
分析:(1)根据能量变化图,反应热等于正反应的活化能减去逆反应的活化能;
(2)①根据升高温度平衡吸热方向移动以及平衡逆向移动平衡常数减小;
②反应是气体体积增大的反应分析判断熵变;
③直接标志:①速率关系:正反应速率与逆反应速率相等,②反应体系中各物质的百分含量保持不变.
间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m+n≠p+q);②各物质的浓度、物质的量不随时间的改变而改变;③各气体的体积、各气体的分压不随时间的改变而改变;
④依据化学平衡三段式列式计算,结合转化率是消耗量除以起始量计算得到;
(3)①依据铵根离子水解的程度分析,主要是所连离子对铵根离子水解的影响分析判断;
②氯化铵溶液中铵根离子水解显酸性,水电离出的氢离子浓度为10-5mol/L,PH=5的盐酸溶液中水电离出的氢离子浓度依据水的离子积计算得到;
③a.A、C两点都在等温线上,压强越大,反应速率越快;
b.A、C两点都在等温线上,平衡常数只与温度有关;
c.A、C两点都在等温线上,压强增大,平衡向气体体积减少的方向移动;
d.该反应为吸热反应,升高温度平衡向逆反应方向移动.
(2)①根据升高温度平衡吸热方向移动以及平衡逆向移动平衡常数减小;
②反应是气体体积增大的反应分析判断熵变;
③直接标志:①速率关系:正反应速率与逆反应速率相等,②反应体系中各物质的百分含量保持不变.
间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m+n≠p+q);②各物质的浓度、物质的量不随时间的改变而改变;③各气体的体积、各气体的分压不随时间的改变而改变;
④依据化学平衡三段式列式计算,结合转化率是消耗量除以起始量计算得到;
(3)①依据铵根离子水解的程度分析,主要是所连离子对铵根离子水解的影响分析判断;
②氯化铵溶液中铵根离子水解显酸性,水电离出的氢离子浓度为10-5mol/L,PH=5的盐酸溶液中水电离出的氢离子浓度依据水的离子积计算得到;
③a.A、C两点都在等温线上,压强越大,反应速率越快;
b.A、C两点都在等温线上,平衡常数只与温度有关;
c.A、C两点都在等温线上,压强增大,平衡向气体体积减少的方向移动;
d.该反应为吸热反应,升高温度平衡向逆反应方向移动.
解答:解:(1)该反应的焓变△H=E1-E2=368KJ/mol-134KJ/mol=+234KJ/mol,所以热化学方程式为:CO2(g)+NO(g)=NO2(g)+CO(g)△H=+234kJ?mol-1;
故答案为:CO2(g)+NO(g)=NO2(g)+CO(g)△H=+234kJ?mol-1;
(2)①)2NH3(g)?N2(g)+3H2(g)△H>0为吸热反应,升高温度,平衡正向移动,平衡常数增大,所以K1<K2,故答案为:<;
②反应是气体体积增大的反应,熵变是增大,△S>0,故答案为:>;
③a.平衡时反应混合物中各组分的含量保持不变,但容器内N2、H2、NH3的浓度之比不一定为为1:3:2,所以不能作为平衡的标志,故a错误;
b.平衡时不同物质表示速率之比等于系数之比说明到达平衡,即3v(N2)正=v(H2)逆说明反应达到平衡,故b错误;
c.反应前后气体体积减小,若压强不变,说明反应达到平衡,故c正确;
d.反应前后气体的质量不变,容器的体积不变,所以密度不变,所以混合气体的密度保持不变不能作为平衡的标志,故d错误;
故选:c;
④一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应.若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的
,设氮气消耗物质的量为x,则依据化学方程式和化学平衡三段式列式计算;
N2(g)+3H2(g)?2NH3(g)
起始量(mol) 1 3 0
变化量(mol)x 3x 2x
平衡量(mol)1-x 3-3x 2x
则(1-x)+( 3-3x)+2x=
(1+3)
计算x=0.2mol;
则N2的转化率α(N2)=
×100%=20%;
故答案为:20%;
(3)①有相同温度下相同浓度的三种盐溶液:A.NH4HCO3,碳酸氢根离子水解促进铵根离子水解;B.NH4 HSO4,溶液中氢离子对铵根离子的水解起到抑制作用;C.NH4Cl溶液中氯离子对铵根离子水解无影响,铵盐水解显酸性,所以按pH由大到小的顺序排列ACB;
故答案为:ACB;
②常温常压下pH均等于5的NH4Cl和HCl溶液,氯化铵溶液中铵根离子水解显酸性促进水的电离,盐酸溶液中氢离子对铵根离子水解起到抑制作用,溶液中水电离出的氢离子浓度依据水的离子积计算得到为10-9mol/L,两种溶液中由水电离出来的c(H+)之比=10-5mol/L:10-9mol/L=104:1;
故答案为:104:1;
③a.A、C两点都在等温线上,压强越大,反应速率越快,所以速率:C>A,故错误;
b.A、C两点都在等温线上,平衡常数只与温度有关,所以化学平衡常数:A=C,故错误;
c.A、C两点都在等温线上,C点压强更高,压强增大,平衡向气体体积减少的方向移动,即逆反应方向移动,N2O4的转化率降低,所以两点N2O4的转化率:A>C,故正确;
d.该反应为吸热反应,升高温度平衡向正反应方向移动,NO2的体积分数增大,所以由状态B到状态A,可以用加热的方法,故正确;
故选:cd.
故答案为:CO2(g)+NO(g)=NO2(g)+CO(g)△H=+234kJ?mol-1;
(2)①)2NH3(g)?N2(g)+3H2(g)△H>0为吸热反应,升高温度,平衡正向移动,平衡常数增大,所以K1<K2,故答案为:<;
②反应是气体体积增大的反应,熵变是增大,△S>0,故答案为:>;
③a.平衡时反应混合物中各组分的含量保持不变,但容器内N2、H2、NH3的浓度之比不一定为为1:3:2,所以不能作为平衡的标志,故a错误;
b.平衡时不同物质表示速率之比等于系数之比说明到达平衡,即3v(N2)正=v(H2)逆说明反应达到平衡,故b错误;
c.反应前后气体体积减小,若压强不变,说明反应达到平衡,故c正确;
d.反应前后气体的质量不变,容器的体积不变,所以密度不变,所以混合气体的密度保持不变不能作为平衡的标志,故d错误;
故选:c;
④一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应.若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的
| 9 |
| 10 |
N2(g)+3H2(g)?2NH3(g)
起始量(mol) 1 3 0
变化量(mol)x 3x 2x
平衡量(mol)1-x 3-3x 2x
则(1-x)+( 3-3x)+2x=
| 9 |
| 10 |
计算x=0.2mol;
则N2的转化率α(N2)=
| 0.2mol |
| 1mol |
故答案为:20%;
(3)①有相同温度下相同浓度的三种盐溶液:A.NH4HCO3,碳酸氢根离子水解促进铵根离子水解;B.NH4 HSO4,溶液中氢离子对铵根离子的水解起到抑制作用;C.NH4Cl溶液中氯离子对铵根离子水解无影响,铵盐水解显酸性,所以按pH由大到小的顺序排列ACB;
故答案为:ACB;
②常温常压下pH均等于5的NH4Cl和HCl溶液,氯化铵溶液中铵根离子水解显酸性促进水的电离,盐酸溶液中氢离子对铵根离子水解起到抑制作用,溶液中水电离出的氢离子浓度依据水的离子积计算得到为10-9mol/L,两种溶液中由水电离出来的c(H+)之比=10-5mol/L:10-9mol/L=104:1;
故答案为:104:1;
③a.A、C两点都在等温线上,压强越大,反应速率越快,所以速率:C>A,故错误;
b.A、C两点都在等温线上,平衡常数只与温度有关,所以化学平衡常数:A=C,故错误;
c.A、C两点都在等温线上,C点压强更高,压强增大,平衡向气体体积减少的方向移动,即逆反应方向移动,N2O4的转化率降低,所以两点N2O4的转化率:A>C,故正确;
d.该反应为吸热反应,升高温度平衡向正反应方向移动,NO2的体积分数增大,所以由状态B到状态A,可以用加热的方法,故正确;
故选:cd.
点评:本题主要考查了热化学方程式的书写、化学平衡常数、化学平衡图象、平衡状态的判断等,题目难度中等,侧重对学生能力的考查.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目