题目内容
在一定条件下,某密闭容器中发生如下可逆反应:2SO2(g)+O2(g)==2SO3(g)+Q;达到化学平衡时,SO2、O2和SO3的物质的量之比3:2:4。其它条件不变,升高温度达到新的化学平衡时,二氧化硫为1.4mol,O2为0.9mol,则此时SO3的物质的量为( )
| A.1.4mol | B.1.6mol | C.1.8mol | D.2.0mol |
A
升高温度平衡向吸热反应方向即逆向移动
_ 2SO2 + O2 == 2SO3
平1n:
△n: 2n n 2n
平2n: 1.4mol 0.9mol
所以: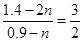 ,可求出n=0.1。则原先平衡时SO2为1.2mol,SO3为1.6mol,新平衡时SO3为1.4mol
,可求出n=0.1。则原先平衡时SO2为1.2mol,SO3为1.6mol,新平衡时SO3为1.4mol
_ 2SO2 + O2 == 2SO3
平1n:
△n: 2n n 2n
平2n: 1.4mol 0.9mol
所以:
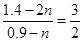 ,可求出n=0.1。则原先平衡时SO2为1.2mol,SO3为1.6mol,新平衡时SO3为1.4mol
,可求出n=0.1。则原先平衡时SO2为1.2mol,SO3为1.6mol,新平衡时SO3为1.4mol
练习册系列答案
相关题目
 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )  3C(g)+D(g),达到平衡状态的是( )
3C(g)+D(g),达到平衡状态的是( ) 4HCl(g)+O2 (g) ΔH>0,在一定条件下达到平衡后,分别采取下列措施,试回答:(1-4题填“增大”、“减小”、或“不变”)
4HCl(g)+O2 (g) ΔH>0,在一定条件下达到平衡后,分别采取下列措施,试回答:(1-4题填“增大”、“减小”、或“不变”) pC(g),达到平衡时,测得c(C)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(C)为0.3 mol·L-1。则下列判断正确的是( )
pC(g),达到平衡时,测得c(C)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(C)为0.3 mol·L-1。则下列判断正确的是( )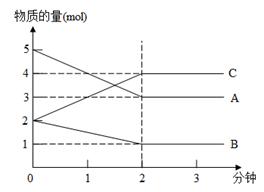
 2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则: