题目内容
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
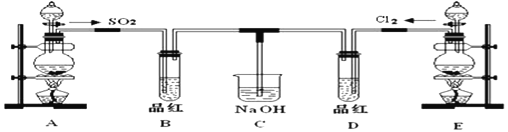
(1)实验室用装置E制备Cl2,离子方程式为__________________。
(2)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是: B:______________,D:_________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B:____________,D:_________________。
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)________________。
【答案】 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 褪色 褪色 恢复为红色 不恢复 Cl2+SO2+2H2O=2HCl+H2SO4
Mn2++Cl2↑+2H2O 褪色 褪色 恢复为红色 不恢复 Cl2+SO2+2H2O=2HCl+H2SO4
【解析】(1)实验室用MnO2和浓盐酸在加热的条件下制备氯气,反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)①氯气和二氧化硫都能是品红溶液褪色,所以B和D装置中品红都褪色,故答案为:品红褪色;品红褪色;
②二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白具有不可逆性,所以看到的现象是B中溶液由无色变为红色,D中无明显现象,故答案为:由无色变为红色或恢复为红色;无明显现象或不恢复;
(3)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,生成物都无漂白性,化学方程式为:SO2+Cl2+2H2O=H2SO4+2HCl;故答案为:SO2+Cl2+2H2O=H2SO4+2HCl。

【题目】在1.013×105Pa下,测得的某些烷烃的沸点见下表。据表分析,下列选项正确的是( )
物质名称 | 沸点/℃ |
正丁烷CH3(CH2)2CH3 | -0.5 |
正戊烷CH3(CH2)3CH3 | 36.1 |
异戊烷 | 27.8 |
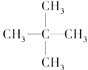
新戊烷 | 9.5 |
正己烷CH3(CH2)4CH3 | 69.0 |
A. 在标准状况时,新戊烷是气体 B. 在1.013×105 Pa、20℃时,C5H12都是液体
C. 烷烃随碳原子数增加,沸点降低 D. C5H12随支链增加,沸点降低