题目内容
将一定质量的Mg-A1合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应.向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如右图.计算下列问题:(写出简要计算过程) 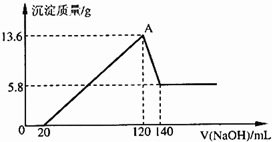
(1)求合金中Mg与Al的物质的量之比?
(2)所加NaOH溶液的物质的量浓度是多少?
(3)原HCl溶液的物质的量浓度是多少?

(1)求合金中Mg与Al的物质的量之比?
(2)所加NaOH溶液的物质的量浓度是多少?
(3)原HCl溶液的物质的量浓度是多少?
分析:根据物质的性质,首先判断曲线各点的意义,以此判断反应的程度,
根据图象纵坐标可判断Al(OH)3和Mg(OH)2的质量,
根据Al(OH)3的两性可计算NaOH的浓度,A点时沉淀量最大,此时溶液溶质为NaCl,
根据n(Na+)=n(Cl-)可计算盐酸的浓度.
根据图象纵坐标可判断Al(OH)3和Mg(OH)2的质量,
根据Al(OH)3的两性可计算NaOH的浓度,A点时沉淀量最大,此时溶液溶质为NaCl,
根据n(Na+)=n(Cl-)可计算盐酸的浓度.
解答:解:(1)由图象可知溶于NaOH溶液的沉淀为13.6g-5.8g=7.8g,该沉淀为Al(OH)3,
物质的量为n(Al(OH)3)=
=0.1mol,即0.1molAl(OH)3,
不溶于NaOH溶液的Mg(OH)2沉淀为5.8g,物质的量为n(Mg(OH)2)=
=0.1mol,
原合金中n(Al)=n(Mg)=0.1mol,故物质的量之比是1:1.
答:合金中Mg与Al的物质的量之比为1:1.
(2)由Al(OH)3与NaOH反应的方程式计算,
Al(OH)3+OH-═AlO2-+H2O
1mol 1mol
0.1mol c(NaOH)×(140-120)×10-3
得c(NaOH)=5mol?L-1
答:所加NaOH溶液的物质的量浓度是5mol?L-1.
(3)图象中A点为沉淀量最大时,此时溶液溶质为NaCl,故n(Na+)=n(Cl-)=0.12L×5mol?L-1=0.6mol,
c(HCl)=
=6mol?L-1
答:原HCl溶液的物质的量浓度是6mol?L-1.
物质的量为n(Al(OH)3)=
| 7.8g |
| 78g/mol |
不溶于NaOH溶液的Mg(OH)2沉淀为5.8g,物质的量为n(Mg(OH)2)=
| 5.8g |
| 58g/mol |
原合金中n(Al)=n(Mg)=0.1mol,故物质的量之比是1:1.
答:合金中Mg与Al的物质的量之比为1:1.
(2)由Al(OH)3与NaOH反应的方程式计算,
Al(OH)3+OH-═AlO2-+H2O
1mol 1mol
0.1mol c(NaOH)×(140-120)×10-3
得c(NaOH)=5mol?L-1
答:所加NaOH溶液的物质的量浓度是5mol?L-1.
(3)图象中A点为沉淀量最大时,此时溶液溶质为NaCl,故n(Na+)=n(Cl-)=0.12L×5mol?L-1=0.6mol,
c(HCl)=
| 0.6mol |
| 0.1L |
答:原HCl溶液的物质的量浓度是6mol?L-1.
点评:本题考查镁铝混合物的计算,题目难度不大,注意分析图象曲线的意义,根据物质的性质结合化学方程式计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H2 2.24L(标准状况),原混合物的质量可能是( )
| A、1.8g | B、3g | C、6.5g | D、10g |
 将一定质量的Mg和Al的混合物投入250mL、2.0mol/L稀硫酸中,固体全部溶解并产生气体0待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
将一定质量的Mg和Al的混合物投入250mL、2.0mol/L稀硫酸中,固体全部溶解并产生气体0待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( ) (2009?长春一模)将一定质量的Mg和Al的混合物投入1mol?L-1500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
(2009?长春一模)将一定质量的Mg和Al的混合物投入1mol?L-1500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( ) 将一定质量的Mg-Al合金用稀盐酸全部溶解,向所得溶液中滴加KOH溶液的体积与生成的沉淀质量关系如图所示.则合金中Al和Mg的物质的量之比为( )
将一定质量的Mg-Al合金用稀盐酸全部溶解,向所得溶液中滴加KOH溶液的体积与生成的沉淀质量关系如图所示.则合金中Al和Mg的物质的量之比为( )