题目内容
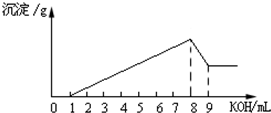 将一定质量的Mg-Al合金用稀盐酸全部溶解,向所得溶液中滴加KOH溶液的体积与生成的沉淀质量关系如图所示.则合金中Al和Mg的物质的量之比为( )
将一定质量的Mg-Al合金用稀盐酸全部溶解,向所得溶液中滴加KOH溶液的体积与生成的沉淀质量关系如图所示.则合金中Al和Mg的物质的量之比为( )分析:氢氧化钾体积为8-9mL时,发生的离子反应方程式为:Al(OH)3+OH-═AlO2-+H2O,根据氢氧根离子计算氢氧化铝,根据Al(OH)3----3OH-计算生成氢氧化铝沉淀需要氢氧化钠的量,1-8mL为氢氧化钠分别与镁离子和铝离子的量,再根据原子守恒进行计算.
解答:解:0-9mL氢氧化钠溶液中发生的化学反应分别为:
0-1mL时,HCl+NaOH=NaCl+H2O,
1-8mL时,MgCl2+2NaOH=Mg(OH)2+2 NaCl、2AlCl3+6NaOH=2Al(OH)3+3 NaCl,
8-9mL时,Al(OH)3+NaOH=NaAlO2+2H2O,
根据8-9mL时Al(OH)3+NaOH=NaAlO2+2H2O知,生成氢氧化铝沉淀需要氢氧化钠的体积是3mL,则生成氢氧化镁沉淀需要氢氧化钠的体积是(8-1-3)mL=4mL,
根据MgCl2+2NaOH=Mg(OH)2+2 NaCl、2AlCl3+6NaOH=2Al(OH)3+3 NaCl知,铝和的物质的量比=
×2:
×1=1:2,
故选A.
0-1mL时,HCl+NaOH=NaCl+H2O,
1-8mL时,MgCl2+2NaOH=Mg(OH)2+2 NaCl、2AlCl3+6NaOH=2Al(OH)3+3 NaCl,
8-9mL时,Al(OH)3+NaOH=NaAlO2+2H2O,
根据8-9mL时Al(OH)3+NaOH=NaAlO2+2H2O知,生成氢氧化铝沉淀需要氢氧化钠的体积是3mL,则生成氢氧化镁沉淀需要氢氧化钠的体积是(8-1-3)mL=4mL,
根据MgCl2+2NaOH=Mg(OH)2+2 NaCl、2AlCl3+6NaOH=2Al(OH)3+3 NaCl知,铝和的物质的量比=
| 3 |
| 6 |
| 4 |
| 2 |
故选A.
点评:本题考查了物质间的反应,明确图象中各段发生的反应是解本题关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H2 2.24L(标准状况),原混合物的质量可能是( )
| A、1.8g | B、3g | C、6.5g | D、10g |
 将一定质量的Mg和Al的混合物投入250mL、2.0mol/L稀硫酸中,固体全部溶解并产生气体0待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
将一定质量的Mg和Al的混合物投入250mL、2.0mol/L稀硫酸中,固体全部溶解并产生气体0待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( ) (2009?长春一模)将一定质量的Mg和Al的混合物投入1mol?L-1500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
(2009?长春一模)将一定质量的Mg和Al的混合物投入1mol?L-1500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )