题目内容
【题目】I.A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图a所示(部分产物已略去)。
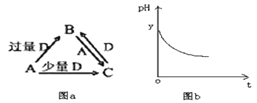
(1)若A为非金属单质,它的组成元素是形成物质种类最多的元素,D是空气的主要成分之一。请写出B的电子式_____________________________________________。
(2)若A为使用最广泛金属的单质,D是某强酸的稀溶液,则反应B+A![]() C的离子方程式为:__________________________________________________。
C的离子方程式为:__________________________________________________。
(3)若A为强碱,D为形成酸雨的气态氧化物。常温时将B的水溶液露置于空气中一段时间,其pH变化如图b所示,则其pH变化的原因是__________________。
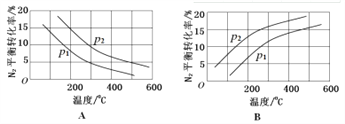
II.(1)对于合成氨反应:N2(g) +3H2(g) ![]() 2NH3(g) △H= -92.4kJ/mol。在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,下列图示正确的是_________(填“A”或“B”);比较p1、p2的大小关系:_____________。
2NH3(g) △H= -92.4kJ/mol。在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,下列图示正确的是_________(填“A”或“B”);比较p1、p2的大小关系:_____________。
(2)尿素是一种高效化肥,与水在一定条件下可以生成氨气:CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g) △H = +133.6kJ/mol。关于该反应,下列说法正确的是___________(填序号)。
2NH3(g)+CO2(g) △H = +133.6kJ/mol。关于该反应,下列说法正确的是___________(填序号)。
A.在平衡体系中再加入少量CO(NH2)2,平衡正向移动
B.降低温度使尿素的转化率减小
C.从反应开始到达到平衡时容器中混合气体的平均相对分子质量始终保持不变
D.恒温恒容时,向平衡体系中再充入少量氨气,平衡常数减小
(3)常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。

NH3·H2O的电离常数为_____________________________(已知lg1.8 = 0.26)。
【答案】 ![]() 2Fe3+ +Fe =3Fe 2+ 2HSO3-+O2=2H++2SO42- A p2>p1 BC 1.8×10-5或10-4.74
2Fe3+ +Fe =3Fe 2+ 2HSO3-+O2=2H++2SO42- A p2>p1 BC 1.8×10-5或10-4.74
【解析】试题分析:本题考查无机推断,化学平衡图像的分析,外界条件对化学平衡的影响,NH3·H2O电离平衡常数的计算。
I.(1)若A为非金属单质,它的组成元素是形成物质种类最多的元素,A为碳;D是空气的主要成分之一,根据图示分析D为O2,B为CO2,C为CO。B(CO2)的电子式为![]() 。
。
(2)若A为使用最广泛金属的单质,A为Fe;D是某强酸的稀溶液,D为稀HNO3,B为Fe(NO3)3,C为Fe(NO3)2;B+A→C的化学方程式为2Fe(NO3)3+Fe=3Fe(NO3)2,离子方程式为2Fe3++Fe=3Fe2+。
(3)若A为强碱,D为形成酸雨的气态氧化物,D为SO2,B为HSO3-,C为SO32-;B的溶液露置于空气中一段时间pH减小,pH发生变化的原因是HSO3-被空气中O2氧化,反应的离子方程式为2HSO3-+O2=2H++SO42-。
II.(1)压强一定时,升高温度,平衡向逆反应方向移动,N2的平衡转化率减小,图示正确的是A。在图A横坐标上任取一点作横坐标的垂直线与曲线相交,由图知p2时N2的平衡转化率大于p1时,增大压强平衡向正反应方向移动,N2的转化率增大,则p2![]() p1。
p1。
(2)A项,CO(NH2)2为固体,在平衡体系中再加入少量CO(NH2)2,平衡不移动,错误;B项,降低温度,平衡向逆反应方向移动,尿素的转化率减小,正确;C项,从反应开始到达到平衡时,容器中混合气由NH3与CO2以2:1物质的量之比混合而成,混合气体的平均相对分子质量恒为17![]() +44
+44![]() =26,正确;D项,恒温恒容时,向平衡体系中再充入少量氨气,平衡向逆反应方向移动,由于温度不变,平衡常数不变,错误;答案选BC。
=26,正确;D项,恒温恒容时,向平衡体系中再充入少量氨气,平衡向逆反应方向移动,由于温度不变,平衡常数不变,错误;答案选BC。
(3)取图中NH4+、NH3·H2O物质的量分数都为50%的点,此时溶液中c(NH4+)=c(NH3·H2O),溶液的pH=9.26,溶液中c(H+)=10-9.26mol/L,c(OH-)=10-14![]() 10-9.26=10-4.74mol/L=1.8
10-9.26=10-4.74mol/L=1.8![]() 10-5mol/L,NH3·H2O的电离方程式为NH3·H2O
10-5mol/L,NH3·H2O的电离方程式为NH3·H2O![]() NH4++OH-,NH3·H2O的电离常数为[c(NH4+)·c(OH-)]/c(NH3·H2O)=1.8
NH4++OH-,NH3·H2O的电离常数为[c(NH4+)·c(OH-)]/c(NH3·H2O)=1.8![]() 10-5。
10-5。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案【题目】CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入足量的活性炭和一定量的NO,发生反应C(s)+ 2NO(g) ![]() N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/(mol/L)/\时间/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
①根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=____________mol·L-1·min-1;计算该反应的平衡常数K=_____________。
②若30min后只改变某一条件,据上表中的数据判断改变的条件可能是____________(填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率___________(填“升高”或“降低”),△H______0(填“>”或“<”)。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式_______________。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_________________________。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10 的溶液,则溶液中c(CO32-)∶c(HCO3-)=_______________。[常温下K1(H2CO3
②欲用2LNa2CO3溶液将4.66gBaSO4 固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为__________________________。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。(忽略溶液体积的变化)




